【二甲双胍|分子细胞卓越中心揭示二甲双胍调控PD-L1降解的新机制】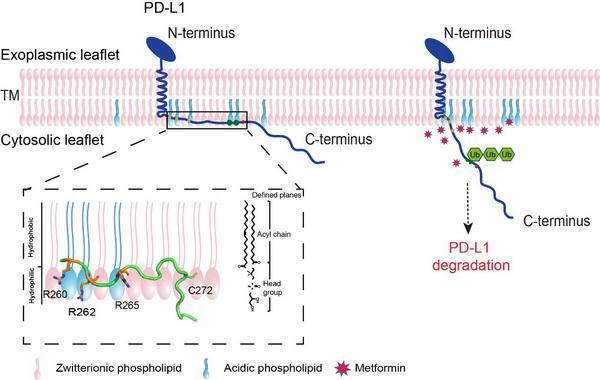
8月24日 , Nature Communications在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)研究员欧阳波研究组的研究成果PD-L1 degradation is regulated by electrostatic membrane association of its cytoplasmic domain 。 研究发现 , 酸性磷脂对PD-L1胞质域(PD-L1-CD)的上膜起着重要调控作用 , 二甲双胍可以竞争性地使PD-L1-CD从膜上解离下来 , 并进一步影响PD-L1的稳定性 。 该研究拓展了对于二甲双胍抗肿瘤分子机制的理解 。
细胞程序化死亡配体1(PD-L1)是在肿瘤细胞表面上高表达的配体分子 , 与T细胞表面细胞程序化死亡受体-1(PD-1)特异性结合后 , 使T细胞功能受到抑制 , 影响T细胞的活化、增殖 , 从而使T细胞失去原有的抗肿瘤杀伤作用 。
近年来 , 以PD-1/PD-L1通路为靶点的免疫检查点抑制剂研究取得进展 。 然而 , 近期研究发现 , PD-L1除了在肿瘤细胞的细胞膜上高表达 , 还大量存在于肿瘤细胞的循环内体、高尔基体和微囊泡上 。 肿瘤细胞会释放富含PD-L1的外泌体 , 对细胞膜表面失活的PD-L1进行补充和更新 , 导致PD-L1的抗体药物无法有效地抑制不断更新的PD-L1从而失效 。 最新的研究发现 , PD-L1-CD存在各种翻译后修饰 , 并在调控PD-L1稳定性和表达水平方面起着关键作用 。 以PD-L1-CD为靶点 , 可以从体内将PD-L1降解 , 彻底清除肿瘤细胞表面和内部的PD-L1 , 是更有效的阻断策略 。 因此 , 了解PD-L1的降解调控机制 , 将提供更多的特异性针对PD-L1的免疫疗法 。
本研究中 , 科研人员使用核磁共振和生化技术 , 发现PD-L1-CD在酸性磷脂存在的情况下 , N端会与膜贴合 。 其中 , 近膜区的三个精氨酸(R260、R262和R265)通过静电作用与细胞膜上的酸性磷脂结合 , 这对PD-L1-CD与膜的相互作用较为关键 。 当PD-L1-CD包埋于细胞膜中时 , 会阻断翻译后修饰和下游降解通路 , 使细胞表面的PD-L1更稳定 , 增加PD-L1的表达 。 突变R260、R262和R265三个精氨酸 , 会影响PD-L1-CD和细胞膜的相互作用 , 从而增强PD-L1的泛素化 , 加速其降解 。 核磁滴定和细胞实验进一步发现 , II型糖尿病药物二甲双胍可以竞争性破坏PD-L1-CD和酸性磷脂的静电作用 , 从而达到降低PD-L1表达的效果 。 研究显示 , 酸性磷脂是细胞膜的组成成分 , 参与调控PD-L1稳定性和降解 。 该研究提出了新的二甲双胍调控细胞中PD-L1水平的机制 , 并为以PD-L1为靶点的相关免疫疗法提供了新思路 。
研究工作得到中科院和国家自然科学基金委员会的支持 。
酸性磷脂调控PD-L1-CD与膜相互作用并影响PD-L1降解的示意图
来源: 分子细胞科学卓越创新中心
推荐阅读
- 淡水鱼无法在海里存活,那么河水入海后,鱼怎么办?
- 34岁男子相亲59次全都失败,沉迷游戏啃老十年,还将父母打进医院
- 重大突破:缓步动物实现了量子纠缠?
- 五星安全 极致守护 红旗H9获C-NCAP五星安全评价
- ?太空技术如何改变我们的生活
- 为何谈起古埃及金字塔,总会与外星人“扯”上关联
- 决定论:人类的一切,早在138.2亿年前,宇宙大爆炸就被注定了?
- 初中生画黑板报走红,人物栩栩如生,班主任感慨:根本舍不得擦掉
- 基因 远在天边,近在眼前——浅谈比邻星
- 基因 上海还比较惨!科学家模拟气温升高3℃:全球50城遭遇重大损失







