
文章图片
想获得国自然选题思路 , 提高国自然基金申请命中率?想调整研究方向 , 获得学术研究突破口?有机会发高分文章?你需要了解学科发展态势和未来走向!赛业生物专栏《Gene of the Week》每周会根据热点研究领域介绍一个基因 , 详细为您介绍基因基本信息、研究概况和应用背景等 , 助您保持学术研究敏锐度 , 提高科学研究效率 , 期待您的持续关注哦 。 今天我们要讲的主角是免疫治疗热门靶点CD47 。
CD47又称为整合素相关蛋白(integrin-associated protein, IAP) , 属于免疫球蛋白超家族 , 是一个拥有5个跨膜域的跨膜糖蛋白 , 广泛表达于几乎所有的正常细胞表面 。 目前已知的CD47的天然配体有三种:整合素(integrin)、血小板反应蛋白-1(Thrombospondin-1 , TSP-1)和信号调节蛋白α(Signal-regulatory proteinα , Sirpα) 。 CD47与其配体主要参与细胞黏附、细胞迁移、吞噬功能 , 以及维持机体免疫稳态 。
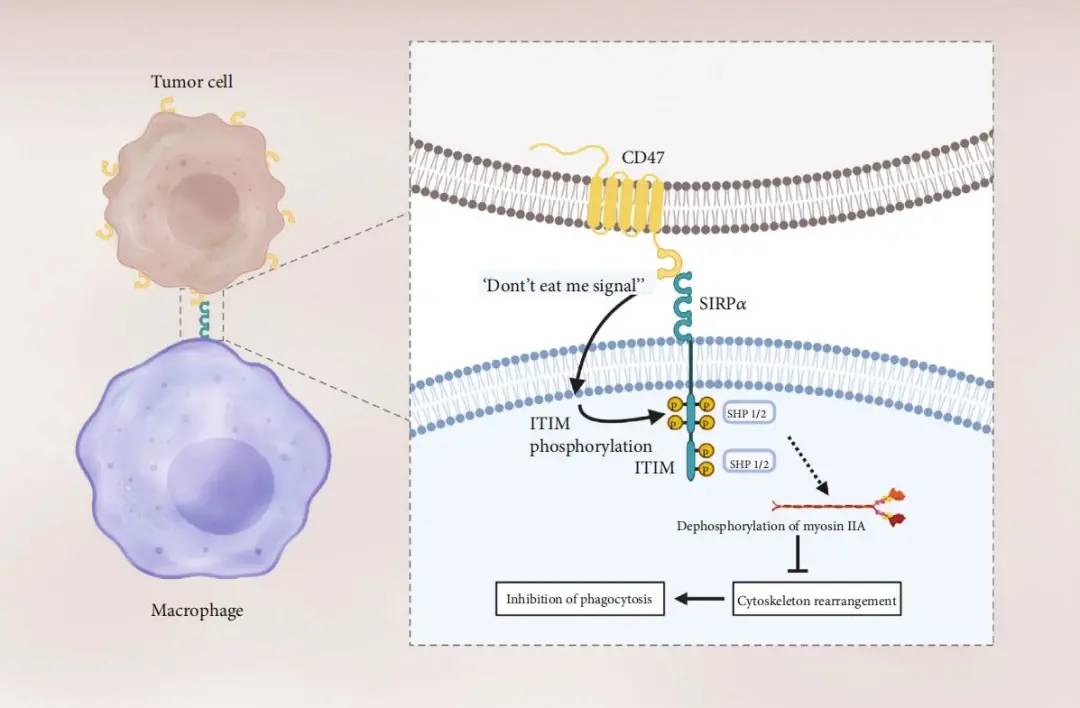
其中 , Sirpα的表达局限于巨噬细胞、树突状细胞以及神经细胞表面 。 在免疫反应中 , CD47主要通过与巨噬细胞表面的Sirpα结合 , 释放一个“别吃我”信号 , 从而保证正常细胞不被巨噬细胞“吃掉”(图1) 。 在这里 , CD47扮演了一个“自我(self)”细胞的标记 , 而一些肿瘤细胞也会利用CD47/Sirpα信号通路 , 高表达CD47以实现免疫逃逸 。
文章图片
图1. CD47/Sirpα在抑制巨噬细胞的吞噬功能中起到重要作用[1] CD47/Sirpα的相互作用导致Sirpα胞内域的免疫受体酪氨酸相关的抑制性基序(immunoreceptor tyrosine-based inhibition motif , ITIM)中的两个酪氨酸残基磷酸化 。 磷酸化招募并激活蛋白酪氨酸磷酸酶SHP1和SHP2 , 传导一系列信号使肌球蛋白II去磷酸化 , 抑制细胞骨架重排 , 而这个步骤是巨噬细胞吞噬靶细胞的必要步骤 。 在肿瘤细胞中 , CD47/Sirpα活性的增强是通过提高CD47的表达量达到的 。
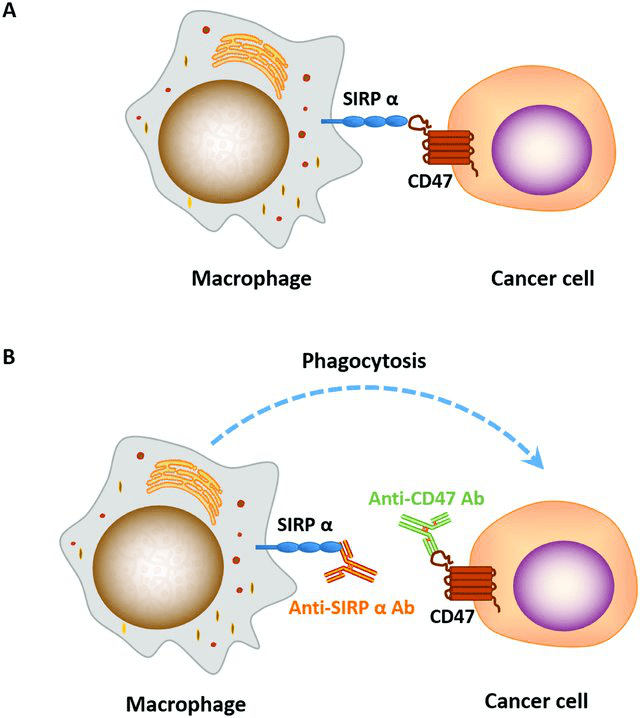
与T细胞抑制性免疫检查点PD-L1类似 , CD47属于巨噬细胞抑制性免疫检查点 。 近年来 , 许多研究者报道使用抗CD47/Sirpα抗体来阻断CD47/Sirpα信号通路可以显著地抑制肿瘤的生长和转移[2] , 因此这条信号通路成为继PD-1/PD-L1、CTLA-4后的另一热门肿瘤免疫治疗靶点(图2) 。 但同时 , 靶向CD47的免疫检查点抑制剂研发也是颇具挑战性的:例如 , 由于血细胞也表达CD47 , 因此在药物设计和临床剂量上要着重考虑血液毒性这一因素 。
文章图片
图2. 抗CD47/SIRPɑ抗体的作用示意图[2] 巨噬细胞上的SIRPɑ与肿瘤细胞表面的CD47结合 , 抑制巨噬细胞对肿瘤细胞的吞噬作用 。 (B)加入抗CD47/SIRPɑ抗体后 , 抗体阻断了巨噬细胞上的SIRPɑ与肿瘤细胞表面的CD47的结合 , 巨噬细胞对肿瘤细胞进行吞噬 。
此外 , 物种间CD47具有不相容性 , 也就是说一般来说 , 普通小鼠的Sirpα不能识别人源CD47(hCD47) , 这导致人源细胞容易被小鼠巨噬细胞吞噬 。 因此进行人源肿瘤细胞系异种移植(cell-derived xenograft , CDX)、人源肿瘤组织异种移植(patient-derived , PDX)时 , 异种移植效果差;使用人外周血单个核细胞(peripheral blood mononuclear cell , PBMC)和人造血干细胞(hematopoietic stem cell , HSC)进行人免疫系统重建时 , 人源化效果也不好 。 但是 , 特别地 , NOD背景小鼠的Sirpα带有突变(SirpαNOD) , 可以与hCD47结合 , 并且它们间的亲和力甚至比hSirpα与hCD47间的亲和力强10倍[3] 。 因此 , SirpαNOD可以有效抑制小鼠巨噬细胞对人源细胞的吞噬作用 , 拥有SirpαNOD的免疫缺陷小鼠对CDX和PDX高度兼容(例如赛业生物的C-NKG重度免疫缺陷小鼠、BRGSF重度免疫缺陷小鼠) 。
综上 , 尽管面临着挑战 , CD47仍然是一个被看好的免疫治疗靶点 。 这从2020年3月 , 制药巨头Gilead公司重金(约49亿美元)收购主打CD47抗体开发的Forty Seven公司就可见一斑 。 未来 , 抗CD47抗体有望成为继PD-1、PD-L1、CTLA-4后的第四类获批上市免疫检查点抑制剂吗?我们拭目以待 。
重度免疫缺陷小鼠助力肿瘤研究
01 BRGSF小鼠表型信息和应用
1. BRGSF小鼠是技术成熟、免疫缺陷程度最大的一种免疫缺陷小鼠 , 相比于目前常见的N*G小鼠 , BRGSF小鼠的免疫细胞中不仅淋系细胞完全缺失 , 其髓系细胞(如巨噬细胞)功能也严重缺失 , 因此其用于肿瘤CDX、PDX模型建立的效果更为优秀 , 适合抗肿瘤药物的药理和药效学研究 。
2. 在基因治疗领域 , BRGSF小鼠同样具有其独特的优势 , 例如CAR-T治疗领域 , 由于BRGSF小鼠为BALB/c背景 , 其体内存在补体依赖性细胞毒性(CDC)机制 , 因此我们可研发或寻找利用CDC机制来消除治疗结束后残留的CAR-T细胞的药物 , 从而降低CAR-T治疗的毒副作用 。
02 C-NKG小鼠表型信息和应用
1. C-NKG小鼠是赛业生物通过CRISPR/Cas9 技术在NOD/Shi-Scid背景品系上敲除Il2rg基因自主研发的一种重度免疫缺陷小鼠 。
2. 缺乏成熟的T、B、NK免疫细胞 , 补体活性降低 , 巨噬细胞对人源细胞吞噬作用弱 , 可高效地移植人造血干细胞(HSC)、外周血单个核细胞(PBMC)、人源肿瘤细胞系异种移植(CDX)、人源肿瘤组织异种移植(PDX) 。
3. 是目前公认的免疫缺陷程度高 , 用于肿瘤、免疫、自身免疫性疾病、免疫治疗疫苗、GvHD/移植、安全性评估等研究的优秀模型 。
References:
[1] Rodrigo C., et al. CD47-SIRPα Axis as a Biomarker and Therapeutic Target in Cancer: Current Perspectives and Future Challenges in Nonsmall Cell Lung Cancer. Jornal of Immunology Research, 2020.
[2] Lu, Quansheng , et al. Potential New Cancer Immunotherapy: Anti-CD47-SIRPαAntibodies. OncoTargets and Therapy, 13:9323-9331(2020).
【赛业|重度免疫缺陷小鼠助力肿瘤研究 - 免疫治疗热门靶点CD47】[3] Lai, Shan, Kwong, et al. Signal-regulatory proteinαfrom the NOD mouse binds human CD47 with an exceptionally high affinity - implications for engraftment of human cells. Immunology, 2014.
推荐阅读
- IT|以色列正式批准开放第四剂新冠疫苗接种 限免疫力低下人群
- 病毒|南非研究:感染“奥密克戎”毒株可增强对“德尔塔”毒株的免疫力
- IT|南非研究表明感染Omicron变种毒株能增强对Delta的中和免疫力
- 结果表明|奥密克戎免疫逃避添更多证据
- 免疫|光滑双脐螺免疫细胞基因组图谱完成
- 免疫|吸一吸,新冠疫苗接种完成
- 代谢|我国科学家在水稻广谱抗病的免疫代谢机制研究中取得进展
- 免疫|揭秘水稻与病原菌争夺的重要装备,上海科学家研究上《自然》
- 模式|如何确保大数据安全?中国工程院院士沈昌祥支招:为信息系统培育“免疫能力”
- 免疫能力|如何确保大数据安全?中国工程院院士沈昌祥支招:为信息系统培育“免疫能力”







