
文章图片
【维真生物】提供AAV现货和AAV包装服务 , 已助力多位客户在顶级期刊发表文章 。
摘要:
腺相关病毒载体是越来越受欢迎的载体工具 , 它可将基因输送到中枢神经系统 , 具有非致病性、免疫原性低、可感染分裂细胞和非分裂细胞的特点 。 它的一个局限性是对神经类细胞的感染有取向性 , 神经胶质细胞特别是星形胶质细胞的感染效率很低 。 为了克服这个局限 , 先前的研究中利用星形胶质细胞的特异性的启动子来构建载体包装病毒 , 以及用不同血清型的病毒来感染星形胶质细胞 , 但是各种研究中的感染效率并不一致 。 在本实验中 , 我们测试了7种商业化的腺相关病毒的血清型 , 血清型1、2、5、6、7、8、9(腺相关病毒由维真生物提供) , 通过观察绿色荧光蛋白(GFP)的表达来测试各种血清型病毒感染星形胶质细胞的能力 。 在细胞培养中 , rAAV6表现出稳定的高效的感染效率 , 而rAAV2只有一些批次的病毒对星形胶质细胞有感染性 。 为了证明我们所用的病毒活性没有问题 , 我们将所用病毒感染公认的易感染细胞ARPE-19细胞并都表现出很高的感染性 。 基于体外实验结果 , 我们选用rAAV6和rAAV2进行了体内实验 , 同样条件下感染星形胶质细胞和神经元细胞 , 感染3个星期后 , 对病毒表达蛋白GFP、神经元细胞特异性标志蛋白NeuN以及星形胶质细胞特异性标志蛋白GFAP进行免疫染色 , 我们发现rAAV6对星形胶质细胞有很高的感染率(90%以上细胞被感染) , 但是对神经元细胞的感染率很低(约10%感染率) , 相反地 , rAAV2对神经元细胞有高感染率(约65%) , 但是不易感染星形胶质细胞(约20%) 。 总之 , 我们的研究表明rAAV6能够被用作对体内星形胶质细胞进行基因表达调控(过表达或敲低)的工具 。
前言
病毒载体在中枢神经系统中广泛用于基因递送和目的基因的表达 。 其中 , 腺相关病毒(AAV)已越来越受欢迎 , 它具有以下优势:非致病性 , 低免疫性 , 能有效转导分裂细胞和非分裂细胞 , 并能产生持久的基因表达 。AAV载体在基础研究中的成功使其应用于临床实践中 , 包括在中枢神经系统中的应用 。 在过去的十年来 , 重组AAV已经应用于脑组织 , 脊髓和视网膜的临床试验中 。 rAAV在基因治疗中的安全性也越来越有吸引力 , 那些在中枢神经系统中的实验 , 以及几种人类单基因疾病的表型校正实验说明了rAAV应用的安全性 , 这也进一步提高了rAAVs在基础研究中的利用价值 。
腺相关病毒(AAV)是一种无包膜的单链 DNA 病毒 , 是细小病毒家族的一员 , 通常需要腺病毒、疱疹病毒等辅助病毒的帮助 , 才能进行自我复制 。 简单的AAV基因组有两个反向末端重复区(ITR) , 其中间有约4.7kb的线性单链DNA的开放阅读框 。rep部分基因组负责编码病毒复制和基因组特异性位点整合的四种蛋白质;另外的cap开放阅读框负责生成三种不同的衣壳蛋白 。 在应用于基础研究和临床实践中的重组AAVs , rep和cap基因被删除 , 取而代之的是目的基因序列或shRNA序列 , 抗生素筛选标记等基因序列 。 因此 , 重组包装AAV需要额外的编码rep基因的质粒(通常衍生自AAV2)和编码cap基因的质粒 , 以及提供腺病毒辅助基因的辅助质粒 , cap基因可来自于各种血清型或进行过基因改造的衣壳蛋白基因) 。
AAV衣壳蛋白的不同决定了它们在依据细胞类型和组织嗜性方面的血清型之间的差异 。原型AAV2与硫酸乙酰肝素蛋白多糖结合从而接近靶细胞 , 并与靶细胞的共同受体相互作用 , 例如整合素αVβ5 , αVβ1 , 肝细胞生长因子和层粘连蛋白 。 有助于其他血清型AAV感染的细胞表面受体的研究的较少 , 普遍认可的有唾液酸或半乳糖的蛋白多糖 。 最近的一篇文章发现了孤儿跨膜蛋白KIAA0319L可作为几种常见的AAV血清型的受体 , 包括AAV6 , 这将有助于我们进一步理解细胞机制(Pillay et al.,2016) 。
星形胶质细胞是中枢神经系统中数量最多、功能最复杂的细胞 , 它对正常大脑功能和许多神经障碍方面有非常重要的作用 。 随着人们对正常和病理细胞研究兴趣的增长 , 对能够有效靶向星形胶质细胞的病毒载体的需求不断增长 。 但是 , 过去大多数的研究都集中在rAAV对神经元细胞的感染上 。 最常用的血清型rAAV2 , 几乎对所有啮齿动物和非人类灵长类动物中的神经元细胞都有应用研究 。 rAAV1,5,8和9也有相同模式的报道(Burger et al., 2004;Cearley and Wolfe,
2006; Dodiya et al., 2010; Markakis et al.,2010) 。 相比之下 , 其他文章还报道了rAAV1,5,8和9对星形胶质细胞有一定的偏好性(Davidson et al., 2000; Foust et al., 2009; Gray et al., 2011;Aschauer et al., 2013; Petrosyan et al., 2014; Watakabe et al.,2015) , 甚至有报道rAAV8和rAAV-rh43对转导星形胶质细胞有优势(Lawlor et al., 2009; Aschauer et al., 2013) 。 不同的血清型的AAV对胶质细胞的取向性不同的原因仍少有报道(更多细节见“讨论”) 。 一些研究对星形胶质细胞的特异性启动子进行了改进 , 如gfa2或gfaABC1D(Merienne et al., 2013; Weinberg et al., 2013) 。 然而 , 即使有这些改进 , 对星形胶质细胞的感染效率并未有很大的提升 , 新的靶向星形胶质细胞的AAV载体将在该领域非常受欢迎 。 这篇文章中我们研究了之前较少研究的rAAV血清型之一 , rAAV6 , 其能有效靶向大鼠大脑皮层的星形胶质细胞 。
材料和方法
材料与试剂
牛血清白蛋白(BSA)、DAPI、N-propyl-gallate、Triton X-100 , 所有的盐和溶剂均购自Sigma–Aldrich (St.Louis, MO, USA) , 均使用最高纯度的 , 除非另有说明 。 细胞培养基、血清、抗生素使用 Gibco R品牌 , 重组蛋白酶TrypLE R购自Life Technologies/Thermo Fisher Scientific(Waltham, MA, USA) 。 所使用的抗体的来源和目录编码在文章中标注 。

文章图片
【维真生物】提供AAV现货和AAV包装服务 , 已助力多位客户在顶级期刊发表文章 。
rAAV载体
血清型rAAV1 , rAAV2 , rAAV5 , rAAV6 , rAAV7 , rAAV8和rAAV9 的腺相关病毒从维真生物公司获得 。 这些病毒是用三质粒共转染293细胞包装制备的 。 主要的质粒pAV-U6-GFP含有AAV2 ITRs序列 , U6启动子后面有shRNA插入位点 , CMV启动子启动EGFP基因表达 , 氨苄青霉素抗性 。 Rep 和 Cap质粒以及辅助质粒提供了病毒复制机器的组件和决定AAV血清型的衣壳蛋白 。 HEK293细胞裂解后 , 病毒颗粒通过碘克沙醇梯度超速离心进行纯化 。 有关这些病毒的详细信息及他们的包装和纯化过程可以在维真生物公司网站查到 。 作为对照 , 根据先前公开的方法(Gao andSena-Esteves, 2012) , 我们也使用了马萨诸塞大学医学院(Worcester , MA , USA)包装的rAAV1 , rAAV2 , rAAV5和rAAV9的腺相关病毒 。 这种腺相关病毒也由三重质粒转染HEK293细胞包装制备的 。 这些病毒载体由CAG启动子编码翻译EGFP蛋白 , 病毒血清型由衣壳蛋白种类决定 。 同样的病毒纯化通过CsCl梯度超速离心方法 。 在以上两类rAAV病毒滴度通过定量聚合酶链反应(qPCR)测定 , 纯度通过蛋白凝胶电泳后考马斯亮蓝染色或银染测定 。
原代大鼠星形胶质细胞和视网膜色素上皮细胞的细胞培养
原代星形胶质细胞是从1-2天龄的Sprague-Dawley大鼠幼仔的大脑中提取制备的 。 所有动物程序严格遵守由国际动物中心和奥尔巴尼医学院使用委员会制定的NIH实验动物护理和使用指南 。 简单来说 , 大鼠幼仔被快速杀死解刨 , 迅速取到大脑组织 。 将皮质与脑膜和海马体分离 , 并置于预冷的Opti-MEM中 。 将脑组织切碎并在等量的含有重组蛋白酶的TrypLE和Opti-MEM混合液中进行酶解 , 并另外补充DNase I(1mg / ml) 。 在37℃下重复用TrypLE进行细胞提取3次 。 第一次提取的细胞不要 , 将最后两次提取的细胞合并并通过1000×g的短暂离心沉降 。 细胞重悬于DMEM中 , 其含有10%热灭活马血清(HIHS)、50 U/mL青霉素和50μg/ mL链霉素 , 然后按每瓶200,000个细胞的密度接种在聚-D-赖氨酸材质的T-75的培养瓶中 。 将培养的细胞放置在含5%CO2的37度培养箱中培养2-4周 。 每周更换两次培养基 。 对星形胶质细胞的标记物胶质纤维酸性蛋白的抗体染色(GFAP , Sigma货号# g3893) , 定期检测培养物纯度 , 纯度需大于 95% 。
人类视网膜色素上皮细胞用作AAV功能的另外的对照 。 已知这种细胞容易被多种血清型的AAV感染(Surace and Auricchio, 2008) 。ARPE-19在含有10%胎牛血清和抗生素的的DMEM中培养 , 同样选用T75培养瓶 。 在用TrypLE提取细胞后定期传代 。
体外rAAV感染和免疫反应过程
将原代星形胶质细胞或ARPE-19细胞接种在24孔板中 , 用七种不同的rAAV病毒分别进行感染 。 基于试验过的滴度摸索实验 , 我们选用105gc/cel的病毒量进行实验 , 这样感染效率最好 。 首先 , 将各种rAAV分别感染的细胞在Opti-MEM 培养基中37℃下进行孵育 , 孵育4h后 , 每个孔补充等体积的DMEM , 星形胶质细胞用含10%HIHS的DMEM , ARPE-19细胞用含10%FBS的DMEM 。 培养20小时 , 根据需要用新鲜的DMEM-HIHS或DMEM-FBS替换含rAAV的培养基 。 48-72小时后测定病毒感染率(GFP表达) 。 测定感染效率的方法:将培养基中的细胞用PBS缓冲液洗涤两次 , 然后用含4%多聚甲醛的PBS缓冲液在室温(20℃)下进行固定 , 再用PBS洗涤两次 , 然后用含0.1%Triton X-100的PBS在室温下透析15分钟 。 再经过两次PBS洗涤 , 然后再用含1%BSA的PBS在室温下封闭1小时 。 免疫反应过程:在室温下 , 将固定好的星形胶质细胞用兔多克隆抗GFP抗体(Life Technologies / Thermo Fisher Scientific , 目录#A6455,1:2,000)或者鸡多克隆抗GFP抗体(Life Technologies / Thermo Fisher Scientific , 目录号A10262 , 1:500稀释)孵育1小时 。 用PBS洗涤三次 , 每次5min , 以除去未结合的一抗 , 然后将细胞与偶联Alexa-Fluor 488的山羊抗兔二抗(Life Technologies / Thermo Fisher Scientific , A11008,1:1,000稀释)或偶联Alexa-Fluor 488的山羊抗鸡二抗(Life Technologies / Thermo Fisher Scientific , 目录#A11039,1:500稀释)进行孵育 , 在室温下封闭1小时 。 用PBS洗涤三次 , 每次5min , 以去除未结合的二抗 。 用DAPI(10μg/ ml)复染细胞 , 在室温下孵育15分钟 , 并用PBS洗涤一次 。 用Zeiss LSM510META共聚焦显微镜(Carl Zeiss , Oberkochen , Germany)捕获Alexa-488荧光图像 。 为确保GFP表达比较的有效性 , 所有图像在相同的条件下进行拍摄 。
rAAV注射动物
根据国际动物保护法 , 以及奥尔巴尼医学委员会制定的关于保护和使用实验室动物的NIH规定 , 在对动物麻醉处理的情况下注射rAAV病毒 。 约200g重的5周龄雄鼠在含30%氧气和70%氮气的环境中用异氟醚进行麻醉(5%浓度用于诱导 , 2%浓度用于维持) , 用直肠探头进行体温检测 , 用加热垫维持老鼠体温在36.5-37度 。 将动物置于啮齿动物立体定位框架上(David KopfInstruments , Tujunga , CA , USA) 。 在头皮皮下局部额外的注射布比卡因(Hospira , Lake Forest , IL , USA)进行头皮麻醉 , 在头皮上做一个切口暴露颅骨 , 接下来 , 在头骨上用力矩II钻(Harvard Apparatus , Holliston , MA , USA)钻一个小孔 , 这个位置在桶状皮层区域的正上方(正中线前方2 mm , 前卤边缘5 mm) 。 用含有rAAV2或rAAV6病毒的注射器注射老鼠的硬脊膜下2.1毫米处 , 注射速度是0.2ul/min,注射病毒量为1ul 。 等待10min以确保病毒进行适当的扩散 , 然后将注射器向上拔出1mm , 再注射1ul的病毒 。 缝合切口 , 按0.1mg/kg的量皮下注射布鲁林诺啡 , 并在伤口处涂抹三联抗生素软膏以愈合伤口 , 术后两天每日两次喂食丁丙诺啡 。 术后喂养3个星期以确保病毒的扩散和标记蛋白GFP的表达 。

文章图片
【维真生物】提供AAV现货和AAV包装服务 , 已助力多位客户在顶级期刊发表文章 。
病毒感染后的免疫反应分析
为了评估病毒的感染效率 , 我们对GFP的表达进行免疫组化分析 。 首先给老鼠注射致死量的戊巴比妥钠 , 然后用含肝素溶液的PBS缓冲液灌注心脏内 , 再用含4%多聚甲醛的PBS缓冲液灌注 。 将大脑取出 , 在4度下用4%多聚甲醛固定24小时 , 然后转移到30%的蔗糖溶液中(4度)进行低温保护 。 取出蔗糖溶液中的脑组织放入Tissue-Tek O.C.T.冰冻切片包埋剂中固定在低温装置中冷冻至-20度 , 然后用Leica CM3050恒冷箱切片机切片 , 片厚25um , 切片防御冷藏液中储存在-20度冰箱中 , 冷藏液的成分为50%的Tris缓冲生理盐水(TBS)、30%乙二醇、20%甘油 。 染色前 , 将切片用TBS缓冲液清洗5次 , 然后在室温下用含3%正常山羊血清(载体实验室 , Burlingame、CA、美国)和0.3%Triton X-100的溶液封闭30分钟 。 首先 , 用兔多克隆抗GFP抗体在4度条件下孵育24-48h , 抗体用3%正常山羊血清稀释 。 然后 , 用TBS缓冲液清洗5次切片 , 再用山羊抗兔标记Alexa–Fluor 488的二抗在常温下孵育2h , 抗体同样用3%正常山羊血清进行稀释 。 为了进一步验证是哪种细胞类型感染了AAV病毒 , 我们将相同的切片用小鼠单克隆抗NeuN抗体((EMD-Millipore, cat. # MAB377, 1:500) 或者小鼠单克隆抗GFAP抗体进行孵育 , 染色程序同上 , 所不同的是所用的山羊抗小鼠的二抗用Alexa–Fluor 555标记((Life Technologies/Thermo Fisher Scientific, cat. #A21422, 1:400) 。 二抗孵育后 , 用TBS清洗5次以除去未结合的二抗 。 然后将脑切片用0.1ug/ml的DAPI在室温下复染15分钟 , 再用TBS清洗一次 , 最后涂抹防褪色剂N-propyl-gallate并用透明指甲油密封 , 置于显微镜下 。 为了保证结果的准确性 , 我们改变了初级抗体的使用顺序并发现当最后用GFP抗体时 , 得到的GFP信号更强 , 而且在初级抗体中加入0.3%的 Triton X-100能使得抗体更好的渗透到切片中 。 需要强调的一点是细胞取向的定量分析都是按照上面介绍的方法进行实验的 , 而且抗体的使用顺序并不会影响病毒感染效率和细胞取向的分析结果 。 所有的切片的荧光图片都是用Zeiss LSM-510 Meta共焦显微镜用250×放大而且是相同的曝光和设置条件下拍摄的 。 半脑图像是用Leica TCS SPE共焦显微镜在15×放大条件下拍摄便于更形象的观察病毒的感染情况 。 一系列的六张图片的展示是用一个具有代表性的图像拼接软件拼接而成 。
数据分析
各种病毒体内感染效率的定量分析以及免疫荧光图片的拍摄都是有两名不知实验目的的审查者和一名初级研究者共同完成 。 对于染色切片或免疫荧光图片中细胞数量的计数取三位实验人员计数的平均值 。 分析的切片数目、注射的动物数量以及总细胞数都在文字和表格中进行了说明 。 统计数字的比较分析采用方差分析和tukey事后检验法 , 使用Origen8.1软件进行多重比较分析 。

文章图片
【维真生物】提供AAV现货和AAV包装服务 , 已助力多位客户在顶级期刊发表文章 。
结论
在常用的七种血清型腺相关病毒中 , rAAV6对大鼠原代星形胶质细胞具有最高的感染效率
为了确定一种能有感染星形胶质细胞的AVV血清型 , 我们选择了7种市售的重组AAV载体:rAAV1, rAAV2, rAAV5, rAAV6, rAAV7, rAAV8,and rAAV9 , 这几种AAV载体都是在CMV启动子下表达GFP蛋白 。 在第一组的一系列实验中 , 我们用两种不同的GFP抗体进行检测 , 只有rAAV6在两组实验中对星形胶质细胞有一致的高效的感染性(图1) 。 作为对照 , 我们同样用两种抗体对未感染病毒的细胞进行了免疫反应检测 , 未检测到免疫反应(图1) 。 其他的rAAV血清型表现出低水平的感染效率 , 只有少量的星形胶质细胞被感染 , 而且感染的细胞的荧光亮度非常弱(图1) 。 有趣的是 , rAAV7和rAAV9对另外一种细胞类型有明显的感染取向性(比如小胶质细胞和少突胶质前体细胞) , 这种细胞目前在星形胶质类细胞中占一小部分(图1箭头所指) 。 为了确定这个结果对不同批次生产的病毒也是有效的 , 首先我们用同一供应商生产的第二批病毒进行了相同的实验 , 我们发现rAAV6对星形胶质细胞仍有很高的感染性 , rAA2也表现出了高感染性 , 这是不同批次病毒的差异性所致(补充图S1) 。 另外 , 我们用了另外一套不同包装方法以及不同启动子的腺相关病毒做了相同的实验 , 我们发现rAA2(AAV2/2)、rAAV1(AAV2/1)以及rAAV5(AAV2/5)有较高水平的感染性(补充图S1) , 但由于病毒量的限制 , 我们未能进行几组细胞的重复实验 , 也未能进行不同批次细胞的实验验证 。
所有上述实验都是用了相同比例的病毒量感染细胞(每个细胞使用105基因组拷贝数病毒) 。 对于rAAV1, rAAV5, rAAV7-9这几种低感染率的病毒 , 我们将这几种病毒感染了RPE细胞系ARPE-19细胞以确定病毒功能正常 , 因为视网膜色素上皮细胞是已知的非常容易被各种血清型AAV感染的细胞(Surace and Auricchio, 2008) 。 我们用了与图1所示实验相同批次相同比例的病毒 , 与感染星形胶质细胞形成强烈对比的是 , rAAV1, 2, 5, 8对ARPE-19细胞表现出了高感染率 , rAAV7和rAAV9也表现出了中度水平的感染率(图2) 。
总之 , 感染星形胶质细胞的体外实验表明 , 在我们实验中选用的几种血清型病毒 , rAAV6表现出一致的高效的感染率 , rAAV2、rAAV1以及rAAV5在不同批次不同生产方式的病毒中也会有一定感染效果 , 而且rAAV2在相同病毒包装方式下 , 不同批次的病毒会有不同效果的感染率 。
在大鼠脑内实验 , rAAV6优先感染星形胶质细胞 , rAAV2更倾向于感染神经元细胞
为了确定rAAV6和rAAV2分别倾向于感染哪种类型的细胞 , 我们将被病毒感染后的脑切片进行了多重免疫染色:病毒表达GFP蛋白 , 神经元特异性标记蛋白NeuN,以及星形胶质细胞特异性标记蛋白GFAP 。 和预期的一样 , 由NeuN的免疫染色形态可看出 , rAAV2很明显的倾向于感染神经元细胞(图4 , AAV2部分) , 形成鲜明对比的是 , rAAV6对神经元细胞几乎没有感染性(图4 , AAV6部分) 。 相反 , 将脑切片中星形胶质细胞标记物GFAP进行染色 , 在rAAV2感染的动物脑切片中 , 我们发现很少的GFP+/GFAP+阳性细胞(图5 , AAV2部分) , 在rAAV6感染的动物脑切片中 , 我们发现一个近乎完美的GFP和GFAP信号之间的重叠(图5 , rAAV6部分) 。 这些数据有力地表明 , rAAV2趋向于感染神经元细胞 , 而rAAV6趋向于感染星形胶质细胞 。
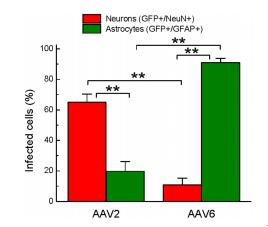
为了量化不同血清型病毒对细胞感染的取向性 , 我们用rAAV2和rAAV6分别注射4只老鼠 , 在250×放大的显微镜下 , 选取5-8个视野盲记GFP+/NeuN+以及GFP+/GFAP+的细胞数目 。 为保证实验的可重现性 , 我们选用了同种包装方式两个批次的病毒进行感染 。 在被rAAV2感染的脑细胞中 , 我们统计有64.9 ± 5.5%的神经元细胞被感染 , 通过计数GFP标记细胞和NeuN标记细胞染色的数目(218/336) , 只有19.8 ± 6.3%的星形胶质细胞被感染(58/284 , 图6) 。 而 GFP+/NeuN- 的大部分细胞根据形态判断仍可能是神经元细胞(神经细胞体和突起较大 , 类似图4 , rAAV2部分) 。 由于在许多切片中 , NeuN的免疫染色偏弱 , 这使得盲鉴定者难以确定准确的双阳性细胞 , 从而统计rAAV2感染神经元的效率偏低 。
相反 , 在被rAAV6感染的脑细胞中 , 我们统计有90.9 ± 2.8%的星形胶质细胞被感染(241/265 , 图6) , 而仅有10.8 ± 4.4%的神经元细胞被感染(14/128 , 图6) 。 可见 , rAAV6对星形胶质细胞有非常强的感染取向 。 通过计数比较 , rAAV2和rAAV6对神经元和星形胶质细胞的感染有非常明显的差异性 。
讨论
本研究的主要发现是 , 市售的rAAV6对大鼠星形胶质细胞有很强的感染性 , 不管是体内还是体外 , 并且可以选择性的感染大鼠皮层星形胶质细胞 。 在7种测试的rAAV中 , 只有rAAV6表现出对星形胶质细胞高的感染性 。 在体内感染中 , rAAV6感染了大脑区域90%以上的星形胶质细胞 , 这是非常有意义的 , 因为目前可用的AAV病毒对星形胶质细胞的感染非常困难 。
正如前言中所说的 , 目前大部分的rAAV都倾向于感染神经元细胞 , rAAV2能感染95%以上的神经元细胞而很难感染星形胶质细胞或其他类胶质细胞 。 我们这项研究中rAAV2实验结果也验证了上述结论 。 也有报道重组AAV1,AAV5, AAV8, and AAV9 对啮齿类和非人类灵长类动物的中枢神经系统有一定的感染性(例如Wang et al., 2003;Cearley and Wolfe, 2006; Taymans et al., 2007; Lawlor et al.,2009; Dodiya et al., 2010) , 但是 , 不知为何这些研究结果都没有可重复性 。 已经有研究用rAAV1, rAAV5, rAAV8, rAAV9, 以及rAAV-rh10和rAAV-hu11注射啮齿类和非人类灵长类动物观察各种血清型病毒对神经胶质细胞特别是星形胶质细胞的感染性((Davidson et al., 2000; Foust et al., 2009; Aschaueret al., 2013; Petrosyan et al., 2014; Watakabe et al., 2015) 。 有研究发现AAVrth43对星形胶质细胞有一定的感染性(Lawlor et al., 2009) , 并且进一步的研究中 , AAV病毒载体选用胶质细胞的启动子Gfa2表达基因 , 由此种病毒载体包装成病毒rAAV5 , rAAV8及rAAV-rh43去感染星形胶质细胞(Lawlor et al., 2009; Drinkutet al., 2012; Merienne et al., 2013) 。 不同研究中rAAV对胶质细胞的感染效率不同 , 造成这种差异性的原因有很多 , 包括大脑区域的不同 , 动物的年龄 , 物种等(Burger et al., 2004;Foust et al., 2009; Aschauer et al., 2013; Weinberg et al., 2013) , 甚至病毒的包装和纯化方法也会对病毒感染星形胶质细胞有一定的影响(Klein et al., 2008) 。 启动子或其他基因因素也有可能造成病毒感染的取向性不同 , 但是没有系统的研究报道 。
这篇研究中我们报道了一种对星形胶质细胞有很高的感染性并且有明显的感染取向的血清型 , rAAV6 。 以前有少量的报道 , 通过比较不同的AAV病毒发现rAAV6对小鼠、大鼠和灵长类动物的脑组织有感染取向(Koerber et al., 2009; Blits et al., 2010; Markakis et al., 2010;Aschauer et al., 2013) 。 rAAV6 对脑部不同区域的星形胶质细胞的感染率不同(Koerberet al., 2009; Aschauer et al., 2013) 。 在另一项研究中 , rAAV6被用于感染人类的恶性胶质瘤细胞 , 这种细胞来源于星形胶质细胞(Huszthyet al., 2005) 。 rAAV6已经在外周组织中被很好的应用 , 对气管上皮细胞、心肌组织和骨骼肌有很高的感染率(Halbert et al., 2001; Blankinship et al.,2004; Palomeque et al., 2007) 。 总之 , 现有的文献中有用rAAV6感染星形胶质细胞的先例 , 但是没有足够的证据证明这种血清型病毒倾向于感染神经元细胞还是星形胶质细胞 。
决定rAAV6感染细胞型取向的原因是什么?我们实验中用了大量的病毒 , 这些病毒都是用相同的包装和纯化方式生产的 , 唯一的不同的是这些病毒的衣壳蛋白不同 , 因此 , 感染星形胶质细胞的差异性可能是有衣壳蛋白的结构决定的 。 虽然我们没有在分子机制上进一步的分析这种现象 , 但是之前的一些文献已经有些报道 。 一些研究发现 , AAV1和AAV6的衣壳蛋白结构约有99%的相似性(Wu et al., 2006c; Huang et al., 2016) 。 在这项实验中 , 我们发现rAAV1和rAAV6在感染原代大鼠星形胶质细胞的效率上有非常大的不同 , 这样的结果是令人意想不到的 , 但并非史无前例 , 在之前的研究报道中 , 有研究发现用这两种血清型的病毒感染大脑和心脏 , 或者用于体外干细胞感染 , 两者也表现出明显的差异(Wu et al., 2006a;Markakis et al., 2010; Zincarelli et al., 2010) 。 有研究者给出的解释是AVV6衣壳蛋白中有几种其关键作用的独特的氨基酸(Wu et al., 2006a) 。 rAAV6 衣壳蛋白中的三个突变点 Y731F/Y705F/T492V显著影响了感染细胞的取向性和感染效率(Rosario et al.,2016) 。
本研究的意义在于发现了一种新的对星形胶质细胞进行基因表达调控的工具 。 以前的报道中 , 选用以gfa2为启动子表达外源基因的rAAV5 , rAAV8和rAAV9感染星形胶质细胞(例如Young et al., 2014; Furman et al., 2016) , 但是 , 这三种病毒对星形胶质细胞的感染效率很容易受病毒包装或其他因素的影响 。 为了说明这一点 , 我们用维真生物公司生产的rAAV5 , rAAV8和rAAV9病毒感染星形胶质细胞 , 发现感染效率非常低 , 但是同样的这三种病毒感染ARPE-19就非常容易 。 其他的一些研究利用最近发现的具有星形胶质细胞感染取向的rhAAV43 , 或者将病毒的衣壳蛋白基因进行改造以提高星形胶质细胞的感染效率(Koerber et al., 2009; Lawloret al., 2009) 。 但是 , 这些情况下病毒感染星形胶质细胞的效率并不高 , 只有一小部分星形胶质细胞表达外源基因蛋白 。 例如 , 将AAV载体进行突变改造后 , 体内感染星形胶质细胞的效率只有15%(Koerber et al., 2009) 。 在本篇研究中 , 我们发现rAAV6在大脑区域感染星形胶质细胞的效率高达90%以上 , 至少这未设计和生产更有效的载体提供一个强有力的起点 。

文章图片
【维真生物】提供现货产品、载体构建、病毒包装、细胞系建立等服务
鉴于过去研究结果的不稳定性 , 我们需要考虑的一个问题是我们的结果能否被别人重现出来 , 我们通过一系列体内和体外的实验来解决这个问题 。 所有星形胶质细胞的感染效率都是通过多批次的病毒感染评估得到 , 无感染效率或低感染效率的病毒都同样的感染ARPE-19细胞 , 这种细胞已被公认的易感染 , 以确定病毒没有问题 。 rAAV6对星形胶质细胞感染的取向性的量化用多个动物体内注射分析得到 , 并且用不同生产方式不同批次的病毒进行实验 , 排除潜在的批次之间的差异 , 最后计数采用盲目选择的方式以减少分析偏见的可能 。 我们所用的rAAV是一种商业化产品 , 有规范的包装和纯化方式 , 因此 , rAAV6可作为对大鼠星形胶质细胞进行基因表达调控的新工具 , 适用于感兴趣的研究者 , 不管其之前有没有AAV病毒包装的经验 。

文章图片
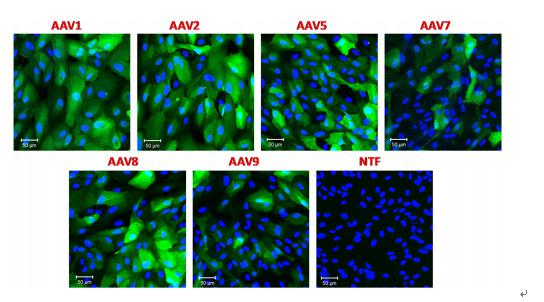
图1 七种表达GFP蛋白的不同血清型的病毒感染原代大鼠星形胶质细胞
【重组|知识分享:六型重组腺相关病毒rAAV6高效并优先感染星形胶质细胞的体内外研究】将rAAV1, rAAV2, rAAV5, rAAV6, rAAV7, rAAV8, or rAAV9分别感染星形胶质细胞 , 使用病毒量为105 gc/cell, 未加任何病毒的细胞作为对照 , 48h后观察 , 上面一行分别是rAAV1, rAAV2, rAAV5, rAAV6 , 下面一行分别是rAAV7, rAAV8, or rAAV9及未感染病毒细胞 。 感染的细胞用兔或鸡抗GFP抗体进行免疫染色 , 并用DAPI进行复染观察未感染的阴性细胞 。 图片用共聚焦显微镜 Zeiss LSM510 META在250×放大下拍摄 , 相同的拍摄条件 。 比例尺=50um , 箭头指向非星形胶质细胞 。 展示的结果是九孔板实验中有代表性的 , 每个实验条件有4组单独的实验 。
文章图片
图2 六种不同血清型的病毒感染APRE-19细胞
用rAAV1, rAAV2, rAAV5, rAAV7, rAAV8, or rAAV9感染APRE-19细胞 , 病毒使用量为105 gc/cell , 72h后观察 。 感染的细胞用兔或鸡抗GFP抗体进行免疫染色 , 并用DAPI进行复染观察未感染的阴性细胞 。 未感染病毒的细胞用同样的方式处理 。 3组重复实验中有代表性的进行拍照 , 用共聚焦显微镜 Zeiss LSM510 META在250×放大下拍摄 , 相同的拍摄条件 。 比例尺=50um 。
文章图片
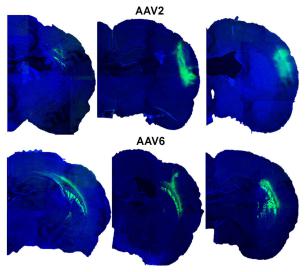
图3 对大鼠皮质注射rAAV2和rAAV6后的体内GFP表达情况
图片选自被相同注射的6个不同动物中具有代表性的 。 注射方法见“材料与方法” 。 注射后3周 , 处理大脑做成25um的切片并用抗GFP抗体染色以及DAPI复染 。 用共聚焦显微镜Leica TCS SPE在15×放大下拍摄免疫荧光图 。 用图片处理软件将六张图片放到一起 。
文章图片
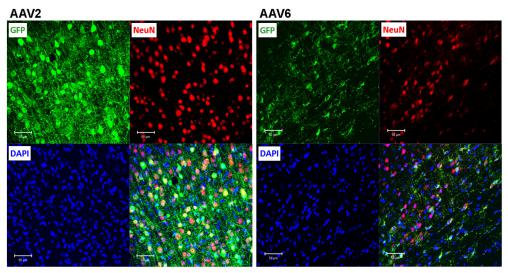
图4 对rAAV2和rAAV6感染神经元细胞能力的评估
将细胞切片中特定蛋白进行染色 , GFP(绿色) , NeuN(红色) , DAPI(蓝色) 。 每组底下右侧的照片为三种颜色的叠加 , 黄色表示共同部分(有的细胞不明显是因为信号强度和细胞位置的原因) , 用共聚焦显微镜 Zeiss LSM510 META在250×放大下拍摄 , 相同的拍摄条件 。 比例尺=50um 。 每组图是用病毒注射4只动物拍摄12张图片中具有代表性的 。
文章图片
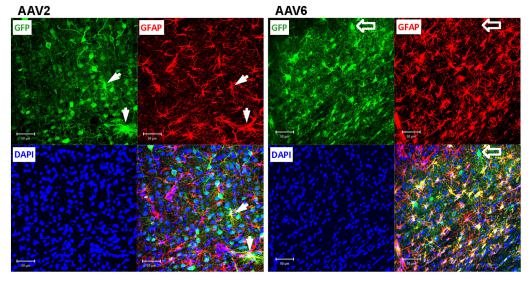
图5 对rAAV2和rAAV6感染星形胶质细胞能力的评估
将细胞切片中特定蛋白进行染色 , GFP(绿色) , NeuN(红色) , DAPI(蓝色) 。 白色箭头指示的是rAAV2感染的星形胶质细胞部分(GFP+/GFAP+) , 尽管绝大部分星形胶质细胞未被感染 。 粗箭头所指的是rAAV6未感染星形胶质细胞的部分(GFP+/GFAP-) 。 用共聚焦显微镜 Zeiss LSM510 META在250×放大下拍摄 , 相同的拍摄条件 。 比例尺=50um 。 每组图是用病毒注射4只动物拍摄12张图片中具有代表性的 。
文章图片
图6 rAAV2和rAAV6对两种细胞类型
感染效率的定量分析
随机选择染色的大脑切片进行分析 。 用两种批次的病毒感染4只动物进行实验收集数据 。 同时有GFP和NeuN阳性信号的区域被定义为感染了神经元细胞 , 同时有GFP和GFAP阳性信号的区域被定义为感染了星形胶质细胞 。 数据用方差分析和事后Tukey检验分析 。

文章图片
【维真生物】提供AAV现货和AAV包装服务 , 已助力多位客户在顶级期刊发表文章 。
推荐阅读
- 新机|快准稳,捕捉每个高光瞬间! 刘衡分享EOS R5拍摄体验
- 问答|紧追B站加码知识类内容,抖音上线“学习频道”
- 显示器|华光昱能知识--DP2.0跟DP1.4有那些不一样?
- 审判|直接服务“三城一区”主平台,怀柔科学城知识产权巡回审判庭成立
- 词条|百度百科上线2500万词条,超750万用户参与共创科普知识内容
- 风险|筛选风险词、用实体类型推断限售商品,阿里安全夺冠知识图谱大赛
- Foxconn|食物中毒事件后 富士康宣布重组印度工厂管理层
- 字节跳动|抖音上线学习频道,为知识内容增加一级入口
- 知识科普|直管内径、凸缘管内径密封快速接头 管内壁粗糙的管口格雷希尔GripSeal连接器
- 训练|华为运动健康 Beta 新版本测试:新增健身课程分享、血压挑战计划







