实验|知识分享:AAV自噬双标病毒

文章图片
【维真生物】提供现货产品、载体构建、病毒包装、细胞系建立等服务
一.关于自噬及LC3
1. 自噬
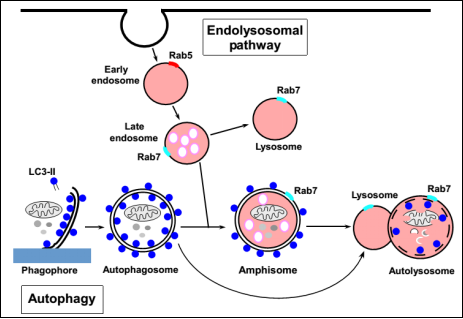
大自噬(macroautophagy) , 也就是通常说的自噬(autophagy) , 是真核细胞蛋白降解的途径之一 。 自噬可以被描述为细胞质内的成分(细胞器、蛋白等)被双层膜的囊泡包裹 , 形成自噬体(autophagosome) , 进而传递到溶酶体进行降解的过程 。 详细来说 , 自噬过程与内涵体途径(endolysosomal pathway)密不可分(见图1) 。 一方面 , 自噬体能够与晚期内体(late endosome)融合形成中间囊泡(amphisome)最终形成自噬溶酶体(autolysosome);另一方面 , 自噬体能够直接与溶酶体(lysosome)融合形成自噬溶酶体 。 无论通过哪条途径 , 自噬溶酶体最终通过酸性水解酶将细胞器、蛋白等消化分解 。
细胞本底水平的自噬发生在营养充足的条件下 , 可保护细胞免受错误折叠蛋白或受损细胞器的影响 , 从而防止某些疾病的发生(如神经退行性疾病和癌症) 。 饥饿等也可诱导自噬的发生 , 通过降解大分子物质和细胞器为细胞活动提供营养和能量 。
文章图片
图1 自噬过程及其与内涵体途径的关系
(Tom Egil Hansen and Terje Johansen , BMC Biology , 2011)

文章图片
【维真生物】提供现货产品、载体构建、病毒包装、细胞系建立等服务
2. LC3
LC3(light chain 3)简称于MAP1LC3(microtubule-associated proteins light chain 3) , 是目前公认的自噬标记物 。 哺乳动物中的LC3与酵母中的自噬相关蛋白Apg8/Aut7/Atg8具有同源性 。
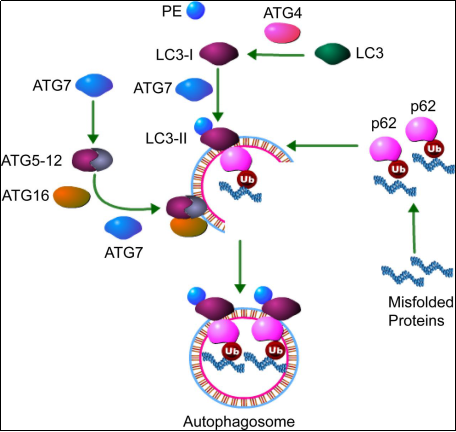
LC3蛋白合成后在其羧基端被Atg4剪切 , 暴露甘氨酸残基 , 产生细胞浆定位的LC3-I 。 在自噬过程中 , LC3-I会被包括Atg7和Atg3在内的泛素样体系修饰和加工 , 与磷脂酰乙醇胺(PE)共价结合 , 形成LC3-II并定位于自噬体膜上(见图2) 。 哺乳动物中的LC3可分为三种: LC3A、LC3B和LC3C 。 其中 , LC3B作为LC3的一种 , 同样可以用作自噬的分子标志 。
文章图片
图2 LC3在自噬体形成中的作用
(Varuna C.Banduseelaet al , Phyciological Genomics , 2012)
二.自噬流检测方法
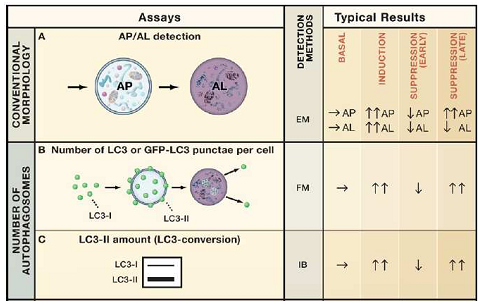
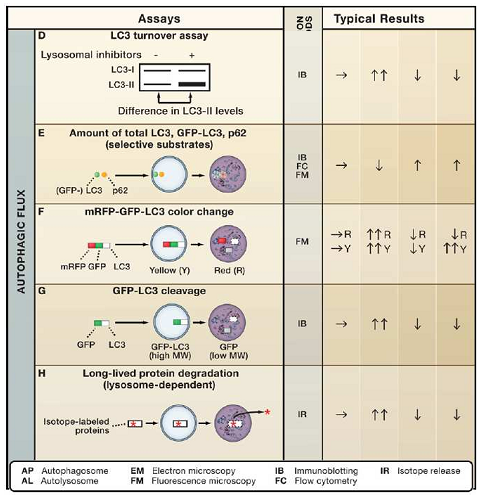
细胞经自噬诱导或抑制后 , 需对自噬流的水平进行观察和检测 , 常用的技术手段见表1:
文章图片
文章图片
表1 自噬体计数及自噬流检测方法汇总
(Mizushima et al, Cell, 2010)
其中 , 电镜观察法由于受到实验条件和设备的限制应用范围有限;而由于自噬过程发生快速 , 通过IB/WB检测LC3-II水平和GFP-LC3的方法易受到实验进行时长的影响 。
想要准确检测自噬流的变化 , 需要多种技术手段共同使用 , 才能达到理想的实验效果 , 产生具有说服性的实验结果 。

文章图片
【维真生物】提供AAV现货和AAV包装服务 , 已助力多位客户在顶级期刊发表文章 。
三.维真生物自噬双标病毒产品
维真生物 mCherry-GFP-LC3B腺病毒
维真生物 mCherry-GFP-LC3B慢病毒
维真生物 mCherry-GFP-LC3B腺相关病毒
四.维真生物自噬双标系统的工作原理
未发生自噬的细胞及含有自噬体的细胞中 , 由于mCherry与GFP共同表达 , 细胞呈现黄色荧光 。 当自噬体与溶酶体融合形成自噬溶酶体后 , 酸性的溶酶体环境使酸敏感的GFP荧光淬灭 , 而mCherry不受影响 , 进而使自噬溶酶体呈现红色荧光 。 因此 , 红色荧光可指示自噬溶酶体形成的顺利程度 。 红色荧光越多 , 绿色荧光越少 , 则从自噬体到自噬溶酶体阶段流通得越顺畅 。 反之 , 自噬体和溶酶体融合被抑制 , 自噬溶酶体进程受阻(见图3) 。
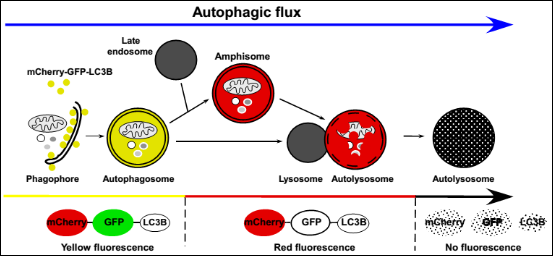
文章图片
图3 mCherry-GFP-LC3B双标系统工作原理
(Tom Egil Hansen and Terje Johansen , BMC Biology , 2011)
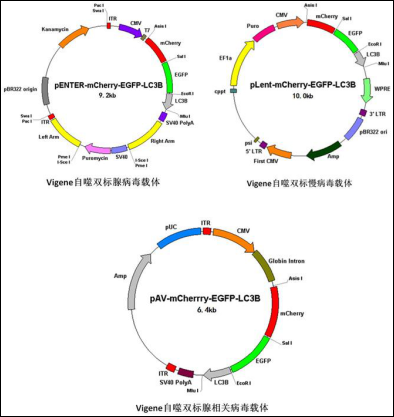
文章图片
图4 维真生物自噬双标病毒载体图谱
五.维真生物 mCherry-GFP-LC3B自噬双标操作方法
(一)体外实验
以2型AAV病毒为例 , 维真生物为您推荐的MOI值104-105 , 是根HEK293细胞得出的数据 , 不同的细胞所使用的病毒MOI值会有所不同 。 建议您感染目的细胞前 , 进行预实验摸索最佳MOI值 , 推荐使用有荧光的对照病毒来摸索条件 。
1. 为了节省病毒 , 推荐使用96孔板进行预实验 。
2. 将目的细胞接种于96孔板中 , 细胞融合率为50%为最佳 。 为保证细胞生长良好 , 请保证细胞贴壁过夜 。
3. 取10ul AAV病毒原液加入90 ul培养基中做1:10稀释(10-1) , 以此为起点做梯度稀释直至稀释10-7 。 可根据实际情况降低或提高稀释倍数 。
4. 取出提前准备好的96孔板 , 先确定细胞生长状况是否良好 。 用准备好的病毒稀释液替代旧培养基 , 注意保留未加入病毒的细胞孔作为对照组 。
5. 在加入病毒稀释液后 , 请在12-24h后观察细胞状态来确认加入的病毒量是否合适 , 是否因为加入的病毒量影响细胞状态 。 如果细胞没有变化 , 即所加病毒对细胞没有毒性 , 可以继续培养 。
6. AAV病毒对细胞的感染较慢 , 请在感染细胞后每天观察细胞中荧光表达情况 。
另:如果您选择的产品没有荧光标签请在96小时以后的不同时间段分别收获细胞并通过Western-Blot或其他检测手段来检测基因表达 。
注:由于AAV组织特异性 , 体外感染细胞的效率比较低 , 所以我们强烈推荐您购买AAV用于动物实验 。
(二)体内实验
针对小鼠/大鼠来说 , 研究不同的方向有不同的AAV注射方法 , 详情可查阅维真生物官网 。
六.常见问题解答
1.重组AAV 安全吗?
迄今为止 , 未发现野生型AAV有致病性 。 野生型AAV , 在无需辅助病毒(如腺病毒)的存在下 , 复制效率非常低 。 重组腺相关病毒(rAAV)由多个质粒(cis质粒、辅助质粒、rep/Cap质粒)组成 。 Cis质粒、辅助质粒与rep/Cap质粒之间不具有同源性序列 , 因此重组AAV在理论上不具有复制的能力 。
2.哪些血清型的 AAV 可供选择?我该选用哪种AAV呢?
目前为您提供的AAV 血清型为AAV1 , AAV2 , AAV5 , AAV7 , AAV6 , AAV8 & AAV9 。 请参阅下面指南中参考文献的建议 。
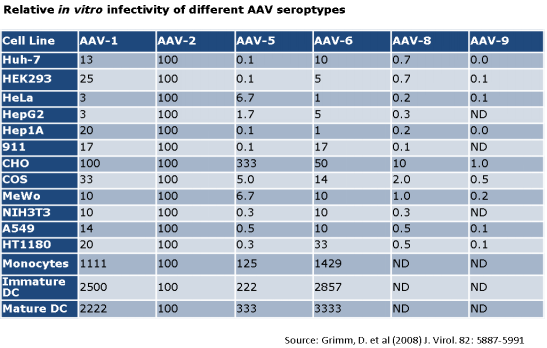
文章图片
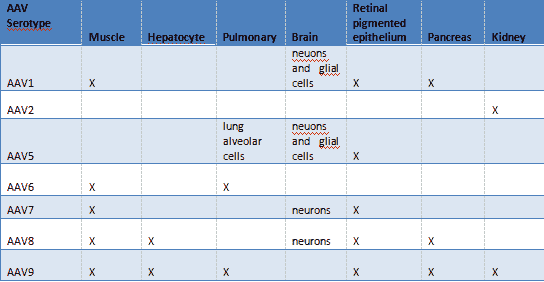
文章图片
请同时参阅转染效率与不同细胞类型对照表 , 以确定哪种血清型AAV更适合您的细胞 。
3.使用重组腺相关病毒rAAV传递基因的优势是什么?
rAAV病毒滴度很高 , 可感染分裂和非分裂细胞、免疫原性极小、体内表达外源基因时间长 。
4.AAV 载体稳定吗? 如何保存AAV载体?
纯化的AAV载体在4℃或更低温度下高度稳定 。 建议您将AAV分装后 , -80℃下长期保存 。
5.订制AAV服务 , 客户需要提供哪些材料? &客户收到的产品是怎样的?
您可以从我们的人源全长cDNA库(17,000预制ORF)中挑选 , 或者提供您的质粒DNA或DNA序列 , 我们将基因克隆至AAV载体 。 您还可以指定特定的融合标签和AAV血清型 。
基因沉默服务 , 请您提供确切的shRNA的序列以构建重组rAAV载体 。 我们的标准载体具有U6启动子和GFP标记 。
通常情况下 , 可为客户提供500 ul病毒液1×10^12 V.G. /mL 。 也可根据客户的需要 , 提供特定体积和滴度的产品 。
附:维真生物自噬双标系统感染诱导自噬的HEK293细胞效果图
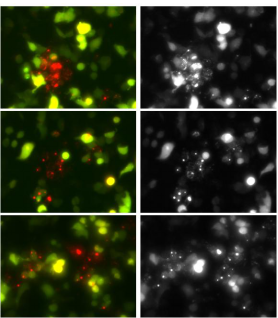
文章图片
【实验|知识分享:AAV自噬双标病毒】
文章图片
【维真生物】提供AAV现货和AAV包装服务 , 已助力多位客户在顶级期刊发表文章 。
推荐阅读
- 产品|泰晶科技与紫光展锐联合实验室揭牌
- 新机|快准稳,捕捉每个高光瞬间! 刘衡分享EOS R5拍摄体验
- 问答|紧追B站加码知识类内容,抖音上线“学习频道”
- 显示器|华光昱能知识--DP2.0跟DP1.4有那些不一样?
- 审判|直接服务“三城一区”主平台,怀柔科学城知识产权巡回审判庭成立
- 词条|百度百科上线2500万词条,超750万用户参与共创科普知识内容
- 风险|筛选风险词、用实体类型推断限售商品,阿里安全夺冠知识图谱大赛
- 字节跳动|抖音上线学习频道,为知识内容增加一级入口
- 知识科普|直管内径、凸缘管内径密封快速接头 管内壁粗糙的管口格雷希尔GripSeal连接器
- 中国|微软 Azure 动手实验营-1月课程预告







