【实验|知识分享:mRNA的分离和纯化】
文章图片
【维真生物】提供现货产品、载体构建、病毒包装、细胞系建立等服务
实验原理
从细胞或组织中得到RNA是一种混合物 , 其中包括tRNA , rRNA和mRNA , 其中RNA为75%~ 85% , tRNA占10%~16% , 而mRNA仅占1%~5% , 并且mRNA基因序列不同 , 分子量大小不均一 , 各基因的表达丰度也不一样 。 每克细胞可分离出5-10mg RNA 。
真核生物mRNA具有5’端帽子结构(m7G)和3’端的poly(A)尾巴 。 绝大多数哺乳动物细胞的3’端存在20-300个腺苷酸组成的poly(A)尾 , 这种结构为真核mRNA分子的分离和纯化 , 提供了极为方便的条件 , 寡聚(dT)纤维素或寡聚(U)琼脂糖亲合层析分离纯化mRNA的实验理论就在于此 。
一般mRNA分离纯化的原理就是根据mRNA 3’端含有poly(A)尾巴结构特性设计的 。 当总RNA流经寡聚(dT)(即oligo(dT))纤维素柱时 , 在高盐缓冲液作用下 , mRNA被特异地吸附在oligo(dT)纤维素柱上 , 在低盐浓度或蒸馏水中 , mRNA可被洗下 , 经过oligo(dT)纤维素柱吸附和解吸附 , 即可得到较纯的mRNA 。
实验材料
1、0.1mol/L NaOH (用0.1% DEPC处理过的无RNase水配置)
2、寡聚Oligo(dT)-纤维素
3、加样/洗涤缓冲液1:0.5 mol/L NaCl, 20 m mol/L Tris-HCl(pH 7.6) , 每组250mL或0.5mol/L NaCl, 20mmol/L Tris-HCl(pH7.6), 1mmol/L EDTA(pH8.0), 0.1% SDS 。 (用0.1% DEPC处理过的无RNase水配置)
4、洗涤缓冲液2:0.1 mol/L NaCl, 20 m mol/L Tris-HCl(pH 7.6) , 每组250mL或10mmol/L Tris-HCl (pH7.6), 1mmol/L EDTA (pH8.0), 0.05% SDS 。 (用0.1% DEPC处理过的无RNase水配置)
5、5 mol/L NaCl(加0.1% DEPC处理过夜)
6、3 mol/L NaAc pH5.2(加0.1% DEPC处理过夜)
7、无RNase双蒸水(DEPC水)
8、70%乙醇(用0.1% DEPC处理过的无RNase水配置)
需要用到的实验仪器:恒温水浴箱 , 高速冷冻离心机 , 紫外分光光度计 , 巴斯德吸管 , 玻璃棉 , 5ml一次性注射器 。
实验过程
(一) oligo(dT)纤维素的预处理
1、用0.1mol/L NaOH悬浮0.5-1.0g oligo(dT)纤维素 。
2、将悬浮液装入填有经DEPC水处理 , 高压灭菌后的玻璃棉的巴斯德吸管中 , 柱床约0.5-1.0mL , 用3倍柱床体积的无RNase的灭菌双蒸水冲洗oligo(dT)纤维素 。
3、用3-5倍柱床洗涤缓冲液I冲洗oligo(dT)纤维素 , 直到流出液的pH值小于8.0 。
4、将处理好的oligo(dT)纤维素从巴斯德吸管倒出 , 用适当的柱床洗涤缓冲液I悬浮 , 浓度约为0.1g/mL , 保存在4℃待用 。
(二)总RNA浓度的调整
1、把总RNA液转到适合的无RNase离心管中 , 测定总RNA的浓度 。 如果总RNA的浓度大于0.55mg/mL , 则用无RNase的双蒸水稀释至0.55mg/mL , 总RNA的浓度对除去rRNA是很重要的 。 浓度调整以后 , 把RNA溶液置于65℃水浴加热5 min , 然后迅速插在冰上冷却 。
2、加入一定体积5 mol/L NaCl使RNA溶液中盐的浓度调至0.5 mol/L 。
(三) mRNA的分离
1、mRNA与Oligo(dT)-纤维素结合:用移液器重新悬浮oligo(dT)-纤维素 , 取适量的oligo(dT)-纤维素到RNA样品中 , 盖上盖子 , 颠倒数次将oligo(dT)-纤维素与RNA混匀 。 于37℃水浴保温并温和摇荡15min 。 oligo(dT)-纤维素与RNA所需量如下表 。
表1 总RNA量所需材料的体积
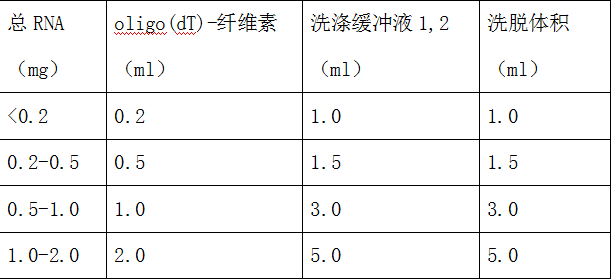
文章图片
2、转移:取1个5ml注射器 , 用经过高温灭菌的玻璃棉塞紧注射器前端 , 注射器固定在无RNase的支架上 , 把oligo(dT)-纤维素/RNA悬浮液加入注射器中 , 把塞子推到底部 , 收集流出的液体 , 即把含有未结合上的RNA液体收集到无RNase的离心管中(保留至确定获得足够的mRNA) 。
3、洗涤:根据表1所需洗涤缓冲液1的体积 , 直接用注射器慢慢吸取 , 温和振荡 , 充分悬浮mRNA-oligo(dT)-纤维素 , 推动塞子 , 用无RNase的离心管收集洗出液 。 测定每一管的OD260 , 当洗出液中OD值为0时准备洗脱 。
4、洗脱:根据表1所需洗脱液体积 , 用注射器慢慢吸取洗脱缓冲液2或无RNase双蒸水到注射器内 , 充分重悬mRNA-oligo(dT)-纤维素 , 推动塞子 , 以1/3至1/2柱床体积分装到无RNase的离心管中 。
5、测定每一管的OD260 , 合并含有RNA的洗脱液 。 在4℃条件下 , 2500g , 离心2-3min , 将上清转移至新无RNase的离心管中 。
6、沉淀:向上清液中加入1/10体积的3mol/L NaAc (pH5.2), 再加入2.5倍体积的冰冷乙醇 , 混匀后 , -20℃条件下沉淀30min或放置过夜 。
7、离心收集:4℃条件下 , 12000g, 离心15min , 小心弃去上清 , 用70%乙醇漂洗沉淀 , 4℃条件下 , 12000g, 离心5 min , 小心弃去上清液 。 沉淀空气干燥10min 。 将mRNA沉淀溶于适当体积的无RNase的双蒸水 , 立即用于后续实验 , 或用70%乙醇溶解 , 贮存于-70℃ 。
8、定量:测定OD260和OD280 , 计算产率以及OD260/OD280的比率

文章图片
注意事项
1、整个操作过程必须严格遵守无RNase操作环境 , 且注意操作中的低温要求 。
2、用于纯化的总RNA样品须尽量保持RNA完整 , 不能被降解 , 获得完整mRNA质量的前提条件 。
3、总RNA与Oligo(dT)-纤维素的比例要适当 , 若总RNA会影响mRNA纯度 。
4、RNA溶液与Oligo(dT)-纤维素结合前必须置于65℃加热5min , 其作用:(1)破坏mRNA的二级结构 , 特别是poly(A+)尾处的二级结构 , 使poly(A+)尾充分暴露 , 提高poly(A+)RNA回收率;(2)解离mRNA与rRNA的结合 。 加热后应立即插入冰上 , 以免由于温度的缓慢下降使mRNA又恢复其二级结构 。
5、应注意mRNA不能被DNA污染 , 否则严重影响实验结果 。
6、mRNA制备后 , 可用变性琼脂糖凝胶电泳捡测其完整性和有无DNA污染 。 提取的mRNA应该在0.5~8.0kb之间呈现弥散状 , 无明显区带 , 但大部分的mRNA应在1-2.0kb范围内呈弥散状 。 经过一次纯化分离的mRNA还会有微量的rRNA残留 , 但一般来说不会对后续实验造成很大的影响 , 如果样品纯化后量足够 , 可将经过一次纯化分离的mRNA再纯化一次 , 进一步提高其纯度 。
7、为防止mRNA降解 , 应避免多次冻融 , 可将mRNA少量分装后保存 。也可将mRNA用70%乙醇溶解 , 在-70℃保存 , 保存时间在一年以上 。
8、Oligo(dT)-纤维素柱用后可用0.3mol/l NaOH洗净 , 然后用层析柱加样缓冲液平衡 , 并加入0.02%叠氮钠(NaN3) , 放在4℃冰箱保存 。 经过预处理后可以重复使用 。

文章图片
【维真生物】提供现货产品、载体构建、病毒包装、细胞系建立等服务
备注:维真生物公司致力于为广大科研工作者提供优质的病毒包装服务 , 服务项目包括:科研级和临床级腺病毒、慢病毒、腺相关病毒(AAV)的包装、质粒载体构建、TALEN 基因敲除、基因突变等 。 目前为止公司已经拥有人源现货质粒库(18 000个)、腺病毒现货库(12 000个)、腺相关病毒(AAV)现货库 , 公司还拥有丰富的定制服务项目 。 真诚欢迎您咨询与选购!
推荐阅读
- 产品|泰晶科技与紫光展锐联合实验室揭牌
- 新机|快准稳,捕捉每个高光瞬间! 刘衡分享EOS R5拍摄体验
- 问答|紧追B站加码知识类内容,抖音上线“学习频道”
- 显示器|华光昱能知识--DP2.0跟DP1.4有那些不一样?
- 审判|直接服务“三城一区”主平台,怀柔科学城知识产权巡回审判庭成立
- 词条|百度百科上线2500万词条,超750万用户参与共创科普知识内容
- 风险|筛选风险词、用实体类型推断限售商品,阿里安全夺冠知识图谱大赛
- 字节跳动|抖音上线学习频道,为知识内容增加一级入口
- 知识科普|直管内径、凸缘管内径密封快速接头 管内壁粗糙的管口格雷希尔GripSeal连接器
- 中国|微软 Azure 动手实验营-1月课程预告







