
文章图片
【维真生物】提供AAV现货和AAV包装服务 , 已助力多位客户在顶级期刊发表文章 。
腺相关病毒(AAV)属于依赖病毒属 , 细小病毒亚科 , 是一类自然缺陷的单链DNA病毒 。 野生型AAV基因组约4.7kb , 含有rep和cap基因以及两端的ITR序列 。 尽管人类对AAV易感 , 但临床还并未发现与AAV相关的疾病 。 根据AAV衣壳蛋白基因的变异 , 可将AAV分为不同的血清型 。 不同血清型的AAV具有不同的组织特异性 。 将兴趣基因取代rep和cap基因构建一个两段带有ITR的载体 , 并将rep和cap置于一个独立的载体上 , 加上带有腺病毒辅助基因载体 , 便可包装出带有兴趣基因的重组腺相关病毒(rAAV) 。
目前rAAV已被广泛作为基因转导载体使用 , rAAV在人体实验中的安全性也已被证实 。 早在1996年 , 科学家们就选择肺作为rAAV的第一个靶向实验器官 。 下面我们旨在介绍rAAV在肺部实验中的启动子、血清型的选择 , 及其小鼠肺部的AAV注射方法 。
一、 启动子的选择
根据不同的注射方式和实验目的 , 可选择不同的启动子以提高肺部表达效率 。 CMV在启动真核基因表达方面具有极高的效率 , 可高效感染小鼠肺部;CAG同样具有出色的感染气道的能力 。
【尼龙|知识分享:AAV在肺部的应用】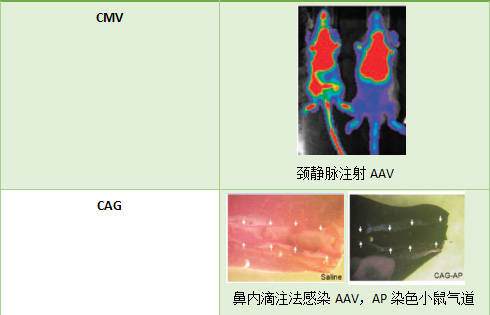
文章图片
维真生物提供适用于肺部的启动子
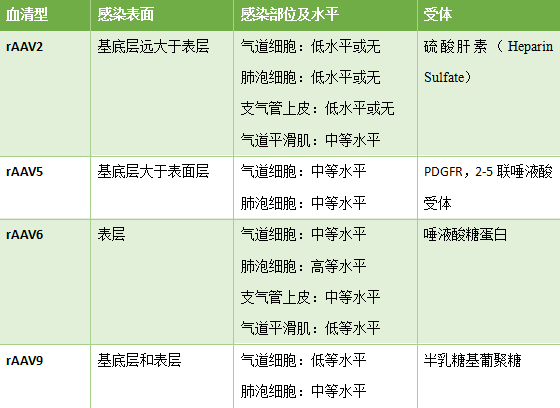
二、 血清型的选择研究表明 , 针对肺部感染rAAV在血清
研究表明 , 针对肺部感染rAAV在血清型上的选择根据动物模型的不同而存在差异 , 主要体现在小鼠及较低等灵长类动物与高等灵长类动物中之间 。
在小鼠及一些较低等的灵长类动物中 , AAV5及AAV6是感染肺部的最佳选择 。
文章图片
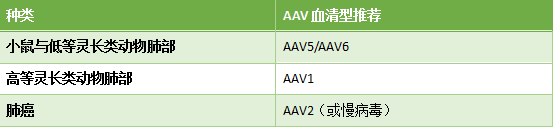
针对高等灵长类动物 , AAV1对肺部的感染效率更高;而在肺癌的研究中 , 我们推荐AAV血清型选择如下:
文章图片
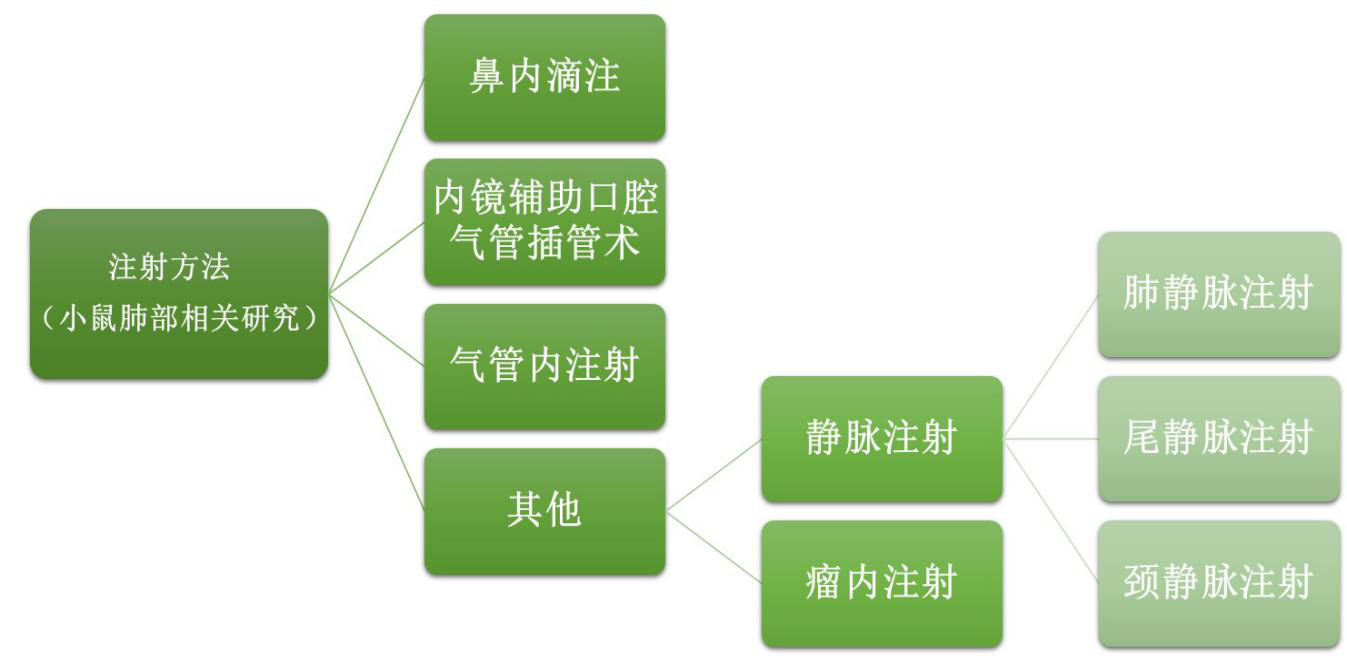
三、 小鼠肺部AAV注射方法
AAV感染肺部有多种方法 , 较为常用的方法为鼻内滴注、气管插管、气管内注射等 。 当对肺部感染AAV的特异性要求较低时 , 也可采用静脉注射的方法;当进行肺癌成瘤实验时 , 也可采用瘤内注射的方式 。
文章图片
在此 , 我们针对鼻内滴注、内镜辅助口腔气管插管术及气管内注射进行介绍 。

文章图片
【维真生物】提供AAV现货和AAV包装服务 , 已助力多位客户在顶级期刊发表文章 。
1. 鼻内滴注法
鼻内滴注法是一种直接的AAV感染法 , 操作简单且对设备要求低 , 对新手实验员也同样适用 。 缺点是AAV颗粒容易沉积在上呼吸道(鼻道、鼻窦和咽)和胃肠道 , 如果需要有效地感染到下呼吸道 , 则可能需要更大剂量的AAV才能实现 。
(1) 腹腔注射氯胺酮和甲苯噻嗪将小鼠麻醉;
(动物必须处于足够深的麻醉状态以防止运动或对载体的反应而打喷嚏或咳嗽)
(2)将小鼠以背卧姿势固定在啮齿动物工作台上;
(3)将门牙环置于小鼠上门牙上 , 并将尼龙搭扣连接到啮齿动物工作台下表面的相应尼龙搭扣上;
(4)慢慢地将AAV悬液通过小鼠鼻孔内壁逐滴滴入 , 为保证最大地肺部感染效率 , 最小体积为50μL(每个鼻孔25μL) , 最大体积为75μL(每个鼻孔37.5μL) 。 待小鼠呼吸恢复正常后 , 再滴入一次75μL的AAV悬液;
(5)将小鼠轻轻从工作台拿下 , 并将头部和胸部用折叠的纸巾小幅度垫高 , 以保证小鼠顺畅的呼吸;
(6)小鼠苏醒后 , 放回鼠笼 。
2. 内镜辅助口腔气管插管术
口腔气管插管术能够将病毒载体直接灌输入肺中 , 却没有外科手术的风险 , 并且避免了上呼吸道的病毒颗粒的损失 。 由于几乎所有AAV病毒颗粒都会到达肺内 , 所以要严格控制AAV的使用量 。 同时 , 与鼻内滴注法相比 , 口腔气管插管术需要一些特殊设备 , 操作起来也稍有难度 。

文章图片
(1) 腹腔注射氯胺酮和甲苯噻嗪将小鼠麻醉;
(动物必须处于足够深的麻醉状态以防止运动或对载体的反应而打喷嚏或咳嗽)
(2) 将小鼠以背卧姿势固定在啮齿动物工作台上;
A. 将门牙环置于小鼠上门牙上 , 并将尼龙搭扣连接到啮齿动物工作台下表面的相应尼龙搭扣上;
B. 小鼠的背部应完全平放在工作台上 , 胸部不应偏向两侧 , 并用尼龙扣完全固定;
(3) 用尖头棉棒把小鼠的舌头卷起;
(4) 轻轻地把附有耳镜的插管镜插入喉咙深部的气管开口处(大约在耳朵前部) , 插管镜的凹面应远离舌头;
(5) 轻轻移动耳镜直到可以看到喉部(有时需稍微旋转镜子 , 以获得最佳视野);操作时需注意动作幅度要小 , 如果只能看到舌头背面 , 则需重新移出从头开始操作;
(6) 当可以看清喉部时 , 便可加入一滴2%的利多卡因 , 在插管前 , 插管镜可移出(小于30s) , 在此期间要定位导管针;
(7) 30秒以后 , 重复步骤(3)—(5) , 重新插入插管镜 , 重新找到可以看清喉部的位置;
(8) 重新可以看清喉部后 , 导管针首先进入气管开口 , 针到位后 , 插管镜可以移出 , 然后引导导管缓缓向下 , 直到导管的中心(粉色部分)接触到小鼠门牙 , 每只小鼠不要尝试2次以上插入导管;
(9) 一旦导管到位 , 要把针移出以便小鼠正常呼吸;
(10) 确定导管在气管内的正确位置;
(11) 用0.35mL的注射器通过导管按照3μL/g体重输入AAV;
(12) 立刻使用1mL无针头注射器输入0.2mL空气 , 并重复2-3次以减少AAV在导管内的残留;
(13) 把导管移出;
(14) 将小鼠轻轻从工作台拿下 , 并将头部和胸部用折叠的纸巾小幅度垫高 , 以保证小鼠顺畅的呼吸;
(15) 对小鼠状态进行监测直到其苏醒 , 预计在24到36小时之内会恢复轻到中度的呼吸 。
3. 气管内注射
与鼻内滴注相比 , 气管内注射能够提高AAV进入肺部的效率;而与口腔气管插管法相比 , 设备更简单 , 操作更容易 。 与此同时 , 气管内注射具有极高的外科手术风险 , 包括出血、切口开裂、感染以及较长的恢复期等 。 不仅如此 , 由于小鼠气管窄小 , 也很容易出现失误 , 将AAV注射到气管周围组织或食管中去 。
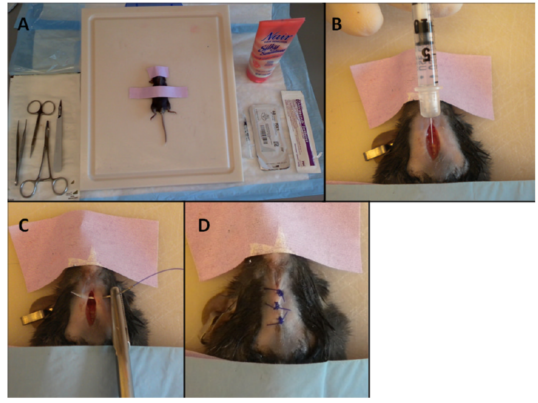
文章图片
(1) 腹腔注射氯胺酮和甲苯噻嗪将小鼠麻醉;
(动物必须处于足够深的麻醉状态以防止运动或对载体的反应而打喷嚏或咳嗽)
(2) 将小鼠以背卧姿势固定在啮齿动物工作台上 , 固定好下巴和四支前端 , 并保证小鼠在45°斜面上 , 头略微抬高;
(3) 去除小鼠颈腹侧的毛发(从喉咙至胸);
(4) 使用湿润的纱布海绵清洗脱毛区域 , 再用含氯溶液擦拭皮肤 , 最后用70%酒精擦拭;
(5) 在小鼠颈上部切一4mm左右切口;
(6) 使用组织镊轻轻穿过皮下组织 , 找到颈部带状肌覆盖的气管;
(7) 在带状肌上轻轻切口暴露气管;
(8) 一旦可以看到气管 , 将针头斜面向上平行插入气管 , 针尖指向肺部 , 按照3μL/g体重输入AAV , 然后将针拔出;
(9) 将切口缝合或使用皮肤胶水粘合;
(10) 将小鼠轻轻从工作台拿下 , 并将头部和胸部用折叠的纸巾小幅度垫高 , 以保证小鼠顺畅的呼吸;
(11) 对小鼠状态进行监测直到其苏醒 。

文章图片
【维真生物】提供现货产品、载体构建、病毒包装、细胞系建立等服务
推荐阅读
- 新机|快准稳,捕捉每个高光瞬间! 刘衡分享EOS R5拍摄体验
- 问答|紧追B站加码知识类内容,抖音上线“学习频道”
- 显示器|华光昱能知识--DP2.0跟DP1.4有那些不一样?
- 审判|直接服务“三城一区”主平台,怀柔科学城知识产权巡回审判庭成立
- 词条|百度百科上线2500万词条,超750万用户参与共创科普知识内容
- 风险|筛选风险词、用实体类型推断限售商品,阿里安全夺冠知识图谱大赛
- 字节跳动|抖音上线学习频道,为知识内容增加一级入口
- 知识科普|直管内径、凸缘管内径密封快速接头 管内壁粗糙的管口格雷希尔GripSeal连接器
- 训练|华为运动健康 Beta 新版本测试:新增健身课程分享、血压挑战计划
- 声音|魏晨分享视频感谢粉丝,手机录视频无修音唱歌,瘦到面部凹陷







