文章图片
肿瘤坏死因子受体超家族(TNFRSF)是一个庞大而重要的免疫调节家族 , 为许多免疫效应细胞提供关键的共刺激信号 。 每一个共刺激TNFRSF成员在不同类型的细胞和免疫反应的不同阶段都有不同的表达谱和独特的功能影响 。 利用TNFRSF介导的信号传导进行肿瘤免疫治疗已成为一个重要的领域 。
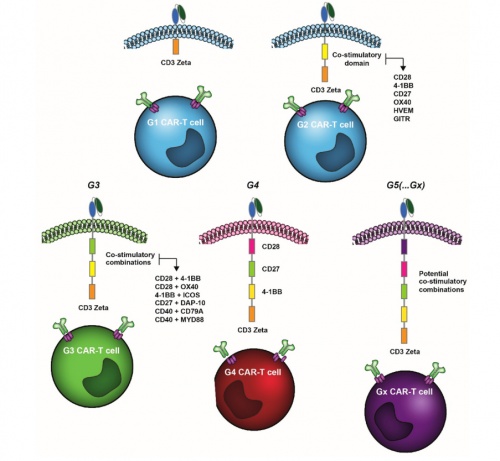
嵌合抗原受体(CAR)-T细胞治疗可能是过去十年免疫治疗中最重大的突破 , 随着CAR-T细胞技术越来越成熟 , CAR结构的组成 , 特别是细胞内结构域也在不断进化 。 第一代(G1)CAR-T细胞结构包含肿瘤相关抗原的高亲和力单链抗体(scFv)、跨膜结构域和唯一的细胞内TCR-ζ或FcR-γ结构域 。 G1 的临床益处有限 , 主要是由于其增殖能力低和体内细胞毒性有限 。 为了克服这一缺点 , 第二代(G2)CAR结构配备了额外的细胞内共刺激结构域 , 最显著的是CD28或TNFRSF成员4-1BB 。 这些G2 CARs被证明是非常有效的 , 几种CAR-T产品在治疗血液瘤方面获得了监管部门的批准 。
【CAR-T细胞中的TNFRSF共刺激域】第三代(G3)CAR-T结构包含了共刺激结构域的组合 , 而第四代(G4)和第五代(G5)CAR-T细胞包含额外的共刺激结构域 , 在抗原识别时诱导表达细胞因子(例如IL-12) , 或包含某些细胞因子受体的细胞内结构域(例如 , 截短的IL-2受体β链和STAT3结合部分) 。 在此 , 我们来一起回顾了TNFRSF的细胞内共刺激结构域在增强和调节CAR-T细胞活性方面的应用 。
4-1BB的共刺激结构域
4-1BB是一种关键的共刺激受体 , 在TCR-MHC相互作用时的T细胞上快速上调 。 其配体4-1BBL在抗原呈递细胞(如巨噬细胞和树突状细胞)上表达 。 4-1BBL与4-1BB的结合导致TRAF1、TRAF2和TRAF3向4-1BB的胞内结构域募集 。 随后 , 形成了包含多种蛋白质(包括激酶和泛素连接酶)的4-1BB信号复合体 , 并最终启动关键信号通路 , 如NF-kB和PI3K-AKT 。 最终 , 4-1BB信号诱导细胞毒性T细胞的增殖、促炎细胞因子的分泌以及效应和记忆T细胞(Tm)的扩增 。
4-1BB的细胞质信号结构域是CAR-T细胞结构中应用最早、探索最多的TNFRSF成员 。 与CD28 CAR-T细胞相比 , 4-1BB共刺激产生具有明显代谢特征的CAR-T细胞 , 如T细胞表面GLUT1表达减少和线粒体呼吸增加 。 这些差异也反映在CAR-T细胞表型和功能上 。 例如 , CD19靶向CAR-T细胞中的4-1BB共刺激在小鼠模型中产生了更有效的B-ALL清除 , 并且4-1BB CAR-T比CD28共刺激的CAR-T细胞持续时间更长 。
目前 , 共有三种使用了4-1BB的CAR-T细胞产品 , 即Tisagenelecluel(Kymriah)、Liscabatagene-Maraluel(BREYANZI)和Idecabatgene-Vicluel(ABECMA) , 已获得FDA批准 。 Tisagenlecleucel是一种CD19靶向G2 CAR-T细胞 , 在93例DLBCL患者进行的临床试验中 , 其产生了强大的药效(52% , ORR;40% , CR;12% , PR) 。 此外 , 观察到强烈但可控的3级或4级副作用 , 如89.7%的患者出现可逆性细胞因子释放综合征(CRS) , 9名患者出现可逆性神经精神事件(31%) 。
Liscabatagene-Maraluel是另一种CD19靶向的G2 CAR-T细胞产品 , 含有4-1BB结构域 , 额外表达表皮生长因子受体(EGFR)的截断版本 。 这种设计考虑到安全性 , 在需要时 , 可以使用Cetuximab清除CAR-T细胞 。 在对256例复发或难治性大B细胞淋巴瘤患者进行的临床试验中 , 其ORR和CR分别为73% 和53% 。
第三种4-1BB CAR-T细胞产品IdecabtageneVicluel是FDA批准的第一种治疗多发性骨髓瘤的CAR-T细胞疗法 , 其靶向多发性骨髓瘤细胞上表达的B细胞成熟抗原(BCMA) 。 在难治性和复发性多发性骨髓瘤(rrMM)患者中的II期临床试验中 , 其ORR为73% , CR达到33% , 26%的患者达到了最小残留病灶(MRD)阴性状态 。 此外 , 在另一项3期研究(NCT03651128)中 , 与标准治疗相比 , Idecabtagene显著改善了ORR(76.4% vs 32.2%)、PFS(11.6vs 3.5个月)和OS(20.2 vs 14.7个月) 。
为了将T细胞效应器功能与T细胞记忆诱导结合起来 , 并实现更持久的临床反应 , 已经开发出包含CD28和4-1BB共刺激结构域的G3CAR-T结构 。 与G2 CAR-T细胞相比 , G3 CAR-T细胞的治疗触发了重要细胞内信号分子(如LAT、ZAP-70、SYK和ERK)的更多磷酸化 。 因此 , G3 CAR-T细胞产生更多的IL-2 , 具有更高的增殖能力和更好的体内持久性 。
几项研究探索了4-1BB G3 CAR-T细胞的临床应用 , 在四名复发性惰性B细胞或套细胞淋巴瘤(MCL)患者中进行了一项小型试验 , 以测试针对靶向CD20的CD28和4-1BB G3CAR-T细胞的安全性 , 该试验证明其总体上安全且耐受性良好 。 值得注意的是 , 其中2名患者CR , 并且在12个月和24个月内没有进展 , 即使在输注后1年 , 血液中也能检测到CAR-T细胞 。 此外 , 针对其他靶点的G3 CAR-T细胞也进行了评估 。 例如 , 前列腺癌靶抗原(PSMA)G3 CD28和4-1BB CAR-T细胞也显示出强大的抗肿瘤活性 。
推荐阅读
- 细胞科技资讯(2022.05.21—2022.05.27)
- 细胞科技资讯(2022.05.14—2022.05.20)
- 乙肝在研新药PBGENE-HBV,临床前研究,靶向cccDNA体内消除HBV
- 1200公里传输实现全球首创,量子卫星再现神威,美罕见承认被领先
- 都在说细胞:干细胞和免疫细胞有何异同?
- 细胞科技资讯(2022.04.30——2022.05.07)
- 多家医院成立CAR-T细胞治疗中心|细胞时代,未来已来
- 干细胞一周资讯(4.16-4.22)
- CAR-NK细胞疗法:令人期待的癌症免疫细胞治疗







