文章图片
文章图片
本文由brainnews脑科学世界团队原创编译 , 转载请联系授权 。
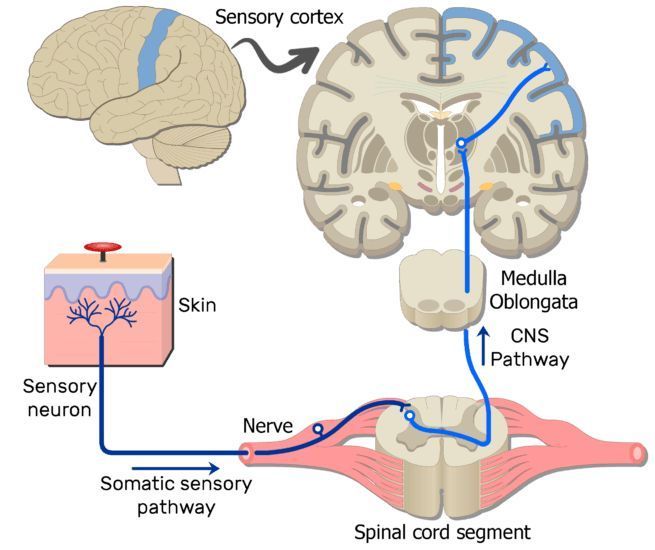
疼痛(pain) , 是一种复杂的生理心理活动 , 是临床上最常见的症状之一 。 它包括伤害性刺激作用于机体所引起的痛感觉 , 以及机体对伤害性刺激的痛反应 。
痛觉可作为机体受到伤害的一种警告 , 引起机体一系列防御性保护反应 。 但另一方面 , 疼痛作为报警也有其局限性(如癌症等出现疼痛时 , 已为时太晚) 。 而某些长期的剧烈疼痛 , 对机体已成为一种难以忍受的折磨 。
图1 疼痛(图源:pain neuron - Bing images)
2022年5月26日 , 加拿大魁北克省蒙特利尔麦吉尔大学麻醉系和牙科医学和口腔健康科学学院Arkady Khoutorsky研究组在Science上发表文章“Microglia-mediated degradation of perineuronal nets promotes pain” , 发现小胶质细胞介导的神经元周围网络降解促进疼痛 。
图2 小胶质细胞介导的神经元周围网络降解促进疼痛
(图源:Shannon Tansley. et al. Science 2022.)
研究人员发现 , 周围神经损伤后 , 小胶质细胞会降解细胞外基质结构 , 即脊髓背角第I层的神经元周围网络(PNN) 。 I层PNN选择性地包裹着脊髓背角投射神经元 , 这些神经元整合脊髓中的痛觉信息 , 并将其传达给脊柱上的大脑区域 , 从而诱发痛觉 。
小胶质细胞对PNN的降解增强了投射神经元的活动 , 并诱发了与疼痛有关的行为 。 因此 , 神经损伤诱导的PNN降解是一种机制 , 小胶质细胞选择性地增强脊髓痛觉回路的输出 , 并导致痛觉过敏 。
据介绍 , 周围神经损伤后脊髓背角的小胶质细胞的激活有助于痛觉过敏的发展 。 被激活的小胶质细胞如何选择性地增强脊髓痛觉回路的活动还不是很清楚 。
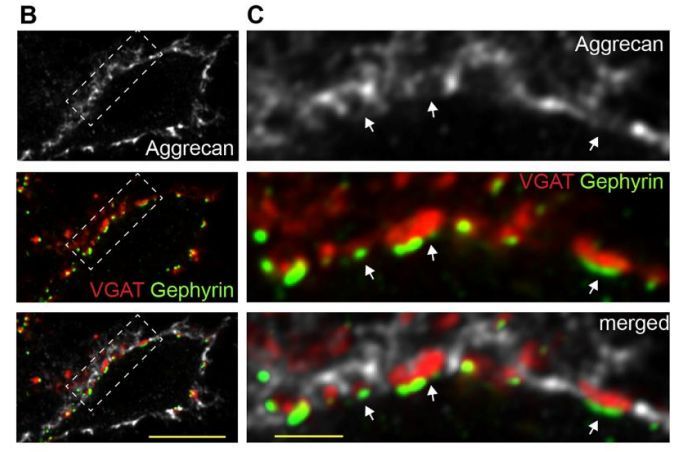
研究人员已经发现了一种机制 , 通过激活小胶质细胞选择性地增加脊髓痛觉回路的输出 , 从而唤起疼痛 。 一亚群I型椎旁棘突投射神经元优先被PNN包围 , 这些PNN在周围神经损伤后以小胶质细胞依赖的方式降解 。 通过减少抑制性突触输入 , PNN的降解足以增强投射神经元的活动 , 并促进疼痛行为 。
图3 抑制性突触结构位于PNNs内(图源:Shannon Tansley. et al. Science 2022.)
而在皮层和海马中 , PNN主要分布在小清蛋白中间神经元周围 , 在脊髓背角 , PNN分布在I层 , 只分布在大直径的投射神经元周围 , 并围绕在较深的板层中各种类型的神经元 。 PNN选择性定位于投射神经元周围 , 而不是背浅角的其他细胞类型 , 允许通过调节PNN来调节投射神经元的活动 , 具有高度的特异性 。
投射神经元是脊髓痛觉回路的主要输出神经元 , 通过降解投射神经元周围的神经网络激活投射神经元是增加脊髓痛觉回路输出的一种具体而有效的机制 。
突触终末嵌入在PNN中 , 因此PNN的组成和稳定性对突触活性有深远的影响 。 去除PNN上带有带负电荷的硫酸基的GAG可能导致突触结构的不稳定 , 降低突触传递效率 。 未来的研究将需要获得更好的机制了解PNN降解对投射神经元周围抑制性突触的影响 。
小胶质细胞通过几种已知的机制在促进疼痛状态中发挥关键作用 。 通过小胶质细胞介导的K+-Cl-共转运体(KCC2)下调 , 导致细胞内氯离子增加和抑制输入减弱 , 从而降低抑制性 , 促进神经性疼痛 。
神经损伤后第7天 , 在I和II板的几种细胞类型中 , KCC2下调和氯离子失调发生 。 小胶质细胞介导的PNN降解选择性地增强了I层投射神经元亚群的活动 , 并在损伤后3天观察到 。 几个小胶质细胞依赖的促痛过程的存在可能与不同的细胞特异性和时间分布并行 , 反映了神经性疼痛机制的复杂性和稳健性 , 并提示有效的治疗应该针对几个过程来逆转过敏 。
图4 小胶质细胞吞噬PNNs(图源:Shannon Tansley. et al. Science 2022.)
小胶质细胞参与介导慢性疼痛的性别差异已被证实 , 尽管神经损伤后 , 小胶质细胞增生在两性中发生的概率相 , 而且并非所有的疼痛模型和脊髓信号通路的元素都是性别二态的 。 研究发现 , 小胶质细胞依赖的PNN降解及其对突触活动和疼痛相关行为的影响在男性和女性中都存在 。
神经元活性促进PV+神经元周围PNN的形成和维持 。 周围神经损伤后 , 脊髓回路活动的增强如何影响I板投射神经元周围PNN的动力学 , 包括它们从退化和长期维持中的恢复 , 仍有待确定 。
推荐阅读
- 爱博医疗:为了七亿人的远方
- 探索长寿的奥秘以造福人类,王萌教授研究揭示溶酶体对寿命的调控
- 人的思维究竟是分子原子层面的还是量子层面的?有何依据?
- Cell 子刊:自闭症社交障碍的最新环路机制
- 航天员名称的来历,我们为什么不叫他们宇航员?
- 《侏罗纪世界》人类真的能和恐龙和平共处吗?别被电影给忽悠了
- 地球带着人类在宇宙中飞奔,一天5200万公里,目的地在哪?
- 什么书籍可以提升科学史话方面?
- \让人闻之色变的“鬼打墙”,其实并非迷信,科学家给出了解释!\







