「前沿」国产CAR-T细胞疗法CT103A疗效强劲:100%缓解率!
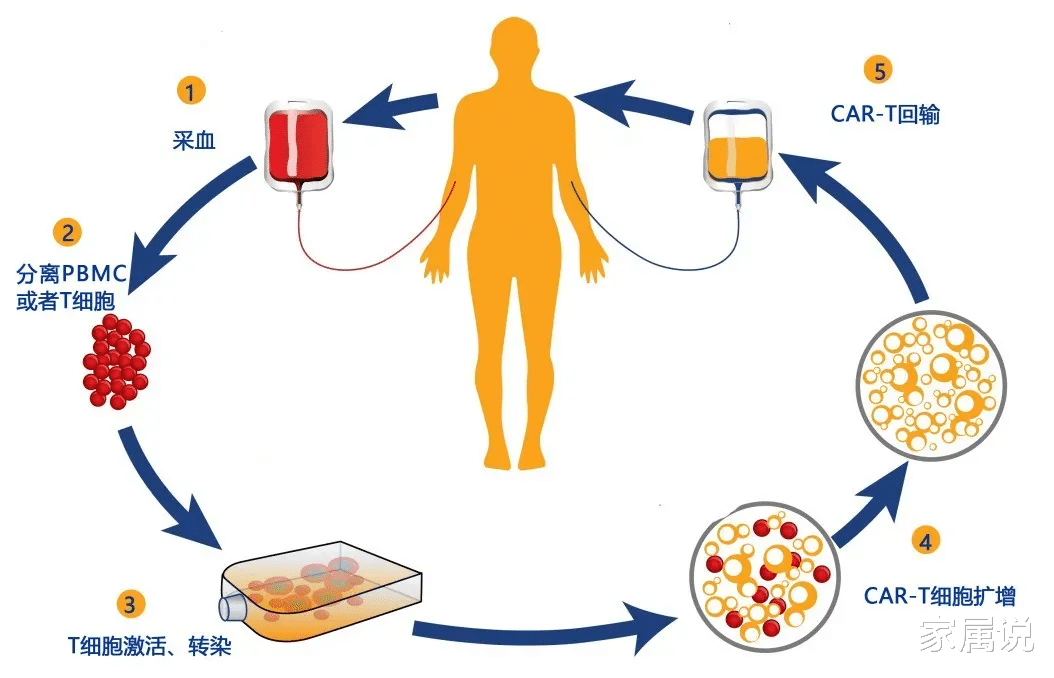
2022年8月3日 , 《OncLive》医学在线期刊公布了一项I/II期FUMANBA-1试验(NCT05066646)的更新数据 , 评估了CAR-T细胞疗法CT103A(通用名:伊基仑赛注射液)在复发或难治性多发性骨髓瘤(MM)患者中的疗效和安全性 。
CT103A是由IASO Bio和Innovent联合开发的一种创新疗法 。 先前的研究表明 , 复发/难治性多发性骨髓瘤患者接受高剂量的靶向BCMA CAR-T细胞治疗可能获得更好的缓解 , 但有更严重的不良事件 。 而且 , 一旦病情再次进展 , 再输注CAR-T细胞也不会奏效 。
为了解决这一难题 , CT103A已被开发出来 , 这是一种慢病毒载体 , 包含一个全人源单链变异片段 , CD8a铰链区 , 跨膜区 , 4-1BB共刺激和CD3ζ激活域的嵌合抗原受体(CAR)结构 。 通过利用专有的内部优化平台 , BCMA CAR-T 的构建是有效和持久的 。
此前 , 2021年2月 , 中国国家药品监督管理局授予CT103A突破性治疗指定 , 用于治疗复发/难治性多发性骨髓瘤患者 。 并于2022年6月 , 正式受理CT103A治疗复发/难治性多发性骨髓瘤(R/R MM)的上市许可申请(NDA) 。
2022年2月 , CT103A被FDA授予孤儿药称号 , 用于治疗复发/难治性多发性骨髓瘤 。
通用名:伊基仑赛注射液
代号:CT103A/IBI326
靶点:BCMA
美国首次获批:尚未获批
中国首次获批:尚未获批
临床数据FUMANBA-1纳入了那些以前接受过至少3种治疗方法的复发或难治性多发性骨髓瘤患者 , 包括蛋白酶体抑制剂和免疫调节药物 。
【「前沿」国产CAR-T细胞疗法CT103A疗效强劲:100%缓解率!】该试验I期的主要终点是安全性和耐受性 , 次要终点包括疗效、药代动力学(PK和药效学(PD) 。 II期的主要终点是客观缓解率(ORR) , 次要终点包括安全性和耐受性、微小残留病(MRD)、总生存期(OS)、缓解持续时间(DOR)、反应时间(TTR)、PK和PD 。
该研究在来自国内14家临床研究中心进行 。 截至2022年1月21日 , 共有79例患者接受了CAR-T细胞疗法CT103A治疗 。 这些患者基线时的中位年龄为57岁 , 其中45%的患者为男性 。 自诊断以来的中位时间为41.3个月 。
既往接受治疗线的中位数为5;所有患者均为双重难治性 , 16.5%的患者为三重难治性 。 27.8%的患者曾接受过自体造血干细胞移植 , 15.2%的患者曾接受过CAR-T细胞治疗 。
该试验数据显示 , 中位随访时间为9.0个月时 , 在可评估的患者群体(n=79)中 , 客观缓解率(ORR)达到了94.9% , 部分缓解或更好的缓解率(PR)为89.9% , 完全缓解率/严格意义的完全缓解率(CR/sCR)率为68.4% 。 中位反应时间(TTR)为16天 。
在患有髓外骨髓瘤(EMM)的10例患者中 , ORR为100% , CR/sCR率为90% 。 之前接受过CAR-T细胞疗法的患者中(n=12) , ORR为75% , CR/sCR率为41.7% 。 在既往接受过CAR-T细胞疗法的无EMM患者中(n=61) , ORR为98.4% , CR/sCR率为70.5% 。
其他数据显示 , 92.4%的患者微小残留病灶(MRD)阴性 , 所有达到CR/sCR治疗的患者MRD阴性 。 此外 , MRD阴性的中位持续时间尚未达到 。
除了那些之前接受过CAR-T细胞治疗的患者外 , 所有队列的中位无进展生存期(PFS)还没有达到 。 在那些之前有CAR-T的患者中 , 中位PFS为7.5个月 。
当研究外周血中的细胞因子时 , 研究人员观察到显著的扩增和持久性 。 还在外周血中评估了血清 BCMA(sBCMA) 。 sBCMA在CAR-T细胞输注后的中位时间为2个月时降至3.2 ng/mL的最低定量限(LLOQ) 。
输注后3个月 , 79例患者中有2.6%检测到了抗药物抗原(ADA);在6个月和12个月时 , 这些比率分别为8.2%和33.3% 。 输注前 , 1.3%的患者检测到ADA 。 中位随访9个月时 , 在CT103A输注后 , 16.5%的患者中检测到ADA 。
安全性在安全性方面 , 93.7%接受CT103A的患者出现3级或更高级别的治疗相关不良反应 , 其中最常见的包括:中性粒细胞减少症(82.3%) , 其次是血小板减少症(59.5%)和淋巴细胞减少症(58.2%) 。 69.6%的患者发生严重不良反应 , 包括肺炎(44.3%)、血小板减少症(21.5%)和肠炎感染(8.9%) 。
大多数患者(94.9%)报告了任何级别的细胞因子释放综合征(CRS) , 73.4%的患者为1级 , 21.5%的患者为2级 。 CRS发病的中位时间为6天 , 中位持续时间为5天 。 2例患者发生了免疫效应细胞相关神经毒性综合征(ICANS) , 这些病例的严重程度为1级和2级 。
小结这项I/II期 FUMANBA-1试验的更新数据显示 , CT103A在复发/难治性多发性骨髓瘤中令人鼓舞的疗效和良好的安全性 。 同时 , 这些结果提示CT103A有望成为治愈多发性骨髓瘤的新型肿瘤免疫治疗方法 , 希望CT103A早日上市 , 为患者带来长期的生存希望!
推荐阅读
- 社交,或成元宇宙的「滑铁卢」
- 只要舔狗功夫深 瞬间搞定细胞村「柔美的细胞们P04」
- 含腾量超高的电影「独行月球」
- 如何看待重庆男子一胎得女后发朋友圈称「晦气」
- 垦丁鹅銮鼻公园挖「51具人骨」!白头骨碎裂4千年前古墓出土
- 《蓝鹦鹉格鲁比科普故事》——前沿科学系列
- 如何评价中国太空授课因一杯水被外国网友质疑为「地面拍摄」?
- 为何叫女性「保护好自己」?她什么都没做错,她只是不幸版的我们
- 3年「没上班」,我靠养蛇月入十万
- ?3年「没上班」,我靠养蛇月入十万







