文章图片
文章图片

一、CAR-T开创者:90%的癌症有望通过“疱疹病毒+CAR-T”治疗!
长期关注小艾的粉丝 , 应该对CAR-T疗法并不陌生 。
CAR-T(Chimeric Antigen Receptor T-Cell)是一种通过人体自身免疫细胞来杀死肿瘤的免疫治疗 。 治疗方式为:从患者血液中提取免疫系统中的T细胞 , 并进行改造 , 为其装备“导航装置”---CAR , 让T细胞能够特异性识别癌症细胞 。 改造后的T细胞能够利用机体自身的免疫反应破坏癌症组织 。 而由于这些细胞来源于患者自身 , 所以患者不易出现严重的免疫排斥反应 , 与标准治疗方式相比具有无可比拟的优势 。
?过去五年中 , 美国食品药品监督管理局(FDA)批准了六种非实体瘤CAR-T疗法:四种用于治疗复发/难治性B细胞恶性肿瘤 , 两种用于治疗复发/难治性多发性骨髓瘤 。
虽然CAR-T在血液肿瘤治疗方面取得了进展 , 但在实体瘤和治疗中并未取得很好的疗效 。 2021年最新的全球癌症数据指出 , 约90%的癌症都是由实体瘤引起 , 如何让CAR-T疗法同样能够攻坚实体瘤 , 成了科学家的努力方向 。
2022年2月2日 , 一项追踪成果表明 , CAR-T细胞在治疗十年后仍然活跃 , 虽然数量较低 , 但仍可测量 , 而且保留了对癌细胞的连环杀伤能力 。
基于此结果 , 宾夕法尼亚大学的免疫学家CarlJune(设计了全球第一种CAR-T治疗方法)认为 , CAR-T细胞实际上可以治愈血液瘤患者 , 实体瘤的研究也可以更进一步 。
要实现CAR-T治疗实体瘤 , 就要先“过河”再精准战斗 。 本质上“打铁还需自身硬” , 通过各种手段为CAR-T叠加“Buff” , 优化CAR-T的结构 , 提高“分辨”实体瘤的能力;其次 , 为CAR-T配备“先锋” , 在前面“过河搭桥” , 让CAR-T顺利打入实体瘤内部 , 联合作战 。
?而在试验探索中 , 研究人员发现 , 单纯疱疹病毒(HSV)比腺病毒等溶瘤病毒更有效 , 它们可以更好地保留在肿瘤部位 , 从而提高CAR-T细胞活性 。 HSV还具有更大的DNA容量 , 意味着可以将多个基因插入同一个载体中 。 如果将它注射到特定的肿瘤中 , 就可以调节肿瘤微环境 , 让CAR-T细胞可以进入肿瘤 。
专家表示 , HSV-CAR-T的创新疗法能够在临床前环境中识别和测试最好的基因组合来武装载体 。 使用基于人类生物学的数据驱动方法来确定目标的优先级 , 并使用计算机模型来选择有效载荷的最佳组合 , 从而在迭代过程中降低研究药物的风险 。 而这也意味着 , 此前无法从CAR-T疗法获益的90%实体瘤患者 , 有望通过“疱疹病毒+CAR-T”治疗获得新的生存希望 。
(资讯来源:生物谷)
二、褐藻多糖硫酸酯肿瘤免疫治疗研究中取得进展
日前 , 学术期刊《国际生物大分子杂志》刊登了中国科学院海洋研究所海藻化学与海洋药物课题组关于褐藻多糖硫酸酯作为免疫刺激剂诱导巨噬细胞定向极化 , 改善肿瘤微环境 , 增强结肠癌对卡培他滨化疗治疗敏感性研究 。
?据介绍 , 该研究结果显示了一种高分子量褐藻多糖硫酸酯FPS1M在肿瘤免疫治疗中的巨大潜力 , 并提示FPS1M联合卡培他滨可能是治疗结肠癌的一种可供选择的组合策略 。
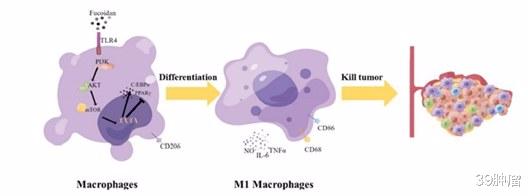
化疗耐药是结直肠癌(CRC)治疗中最关键的挑战之一 , 化疗耐药的发生和发展与肿瘤免疫微环境(TIME)密切相关 。 巨噬细胞是浸润至肿瘤微环境中最重要的免疫抑制细胞 , 是结直肠癌化疗耐药的关键 , 巨噬细胞约占肿瘤总体积的30% , 在肿瘤微环境中表现杀瘤的M1表型和促瘤的M2表型 , 其中 , M2巨噬细胞为浸润至肿瘤的主要细胞类型 。 因此 , 重编程或定向分化巨噬细胞为M1表型是调控肿瘤免疫 , 杀伤肿瘤的有效策略 。
经过前期筛选 , 团队发现 , 一种高分子量褐藻多糖硫酸酯FPS1M能够显著诱导巨噬细胞M1表型的转化 , 这种转化在体内和体外均促进结肠癌细胞的凋亡 。
机制上 , 研究发现 , FPS1M是TLR4的强刺激因子 , FPS1M显著上调了PI3K , AKT , mTOR的磷酸化水平并增加了PPARγ的表达 , 说明FPS1M通过激活TLR4介导的PI3K-AKT-mTOR-PPARγ信号轴 , 促进巨噬细胞糖酵解 , 调节巨噬细胞向M1表型的分化 。







