文章图片

文章图片
文章图片

文章图片
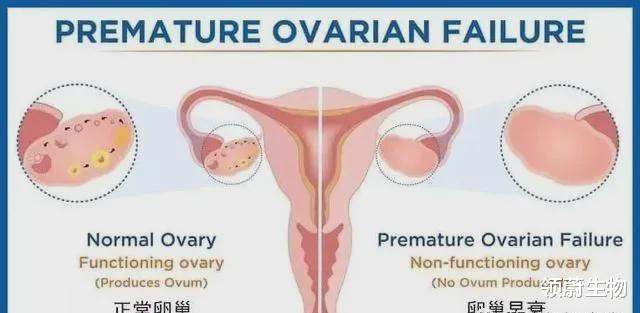
早发性卵巢功能不全 (POI)是指女性在40周岁以前因妊娠以外的原因导致提前闭经 , 并伴有血清雌激素下降、促性腺激素升高的特征 。
欧洲人类生殖和胚胎学学会 (ESHRE)将POI定义为40周岁以下女性 , 因除妊娠以外的原因导致闭经至少4个月 , 而且卵泡期血清检查至少2次(2 次检查间隔时间30d以上)出现卵泡刺激素(FSH)>25 IU/L、雌二醇(E2)<73.2pmol/L 。
对于FSH>40 IU/L的患者过去又称为卵巢早衰POF) 。
POI的病因较为复杂 , 仍有50%~90%的特发性患者未能明确病因 , 已知的病因包括:遗传学因素、医源性因素、自身免疫学、先天性酶缺乏、感染与环境因素等 。
对于自身免疫因素引起的POI患者 , 免疫抑制治疗为其首选方式 , 但长期应用仍存在免疫功能缺陷所致的各类风险 。
目前临床传统疗法对有生育要求的患者无能为力 。
干细胞(stem cells)是 一种具有自我更新能力及多向分化潜能的细胞 , 干细胞来源的外泌体是一种由干细胞分泌产生的微小囊泡 , 可携带多种生物活性物质 。
近年来 ,干细胞因其高度增殖、多向分化等优势被应用于POI的研究中 , 并取得一定疗效 。
本文就不同干细胞及其外泌体对POI的生物学作用和可能的作用机制进行综述 。
成体组织间充质干细胞用于 POI/POF 治疗
人骨髓干细胞
hBMDSCs是一组具有多向分化潜能的异质性单核细胞 , 包括多种造血干细胞、hBM-MSCs和内皮祖细胞 。 其中hBM-MSCs含量不足1% 。
Herraiz等将hBMDSCs经尾静脉注射入化疗诱导POF小鼠及人卵巢移植小鼠(来自POF患者的卵巢皮质组织)两种动物模型体内 , 可观察到hBMDSCs 对卵巢组织的多重再生作用 , 包括增加局部血管形成、增加卵泡和基质细胞数目、恢复生育力等 。
相比hBMDSCs , hBM-MSCs在治疗POF的研究中已取得大量成果 。
Bao等发现POI小鼠接受hBM-MSCs治疗后 , 卵巢内各级卵泡数目增加、性激素水平和生育力均可得到恢复 。
目前更多的学者倾向于hBM-MSCs可向受损卵巢间质组织迁移 , 但不向卵细胞分化 , 而是通过旁分泌途径分泌相关细胞因子改善卵巢间质微环境 , 促进组织修复 。
提示旁分泌途径在hBM-MSCs治疗POF中也发挥了重要作用 。
对于hBM-MSCs作用机制的研究还包括:抑制卵巢颗粒细胞凋亡、促进血管生成、减少细胞外基质沉积从而抗卵巢组织纤维化、 抑制炎症反应以及hBM-MSCs分化为卵巢颗粒样细胞等 。
人脂肪间充质干细胞
hADSCs与hBM-MSCs具有相似的性质 ,在不同条件下可诱导分化为多种中胚层来源细胞 , 并具有取材方便、可自体移植降低免疫排斥反应的优势 。
【卵巢|国际妇产杂志:干细胞及其外泌体治疗早发性卵巢功能不全临床探究】在化疗诱导POF小鼠中 , Sun等将hADSCs通过尾静脉注射和双侧卵巢原位注射两种方式对POF小鼠进行治疗 , 发现hADSCs定位于卵巢间质而非直接分化为卵泡结构细胞 , 且小鼠排卵数目增加 。
人胎盘间充质干细胞
目前 , 对于hPMSCs治疗POF的研究表明 , hPMSCs主要通过免疫调节而发挥作用 。
透明带3多肽(pZP3)免疫损伤诱导的POF小鼠给予hPMSCs移植后 , 观察到卵巢组织内闭锁卵泡减少 ,颗粒细胞凋亡减少 , 且AMH及FSHR表达均增加 。
在机制研究方面 , Yin等认为hPMSCs可以通过影响磷脂酰肌醇3激酶/蛋白激酶B(PI3K/AKT)通路、调节辅助性T细胞17/细胞毒T细胞17(Th17/Tc17)与Th17/调节性T细胞(Treg)之间平衡 , 减少卵泡闭锁及颗粒细胞凋亡 。
人脐带间充质干细胞
hUCMSCs是一种从新生儿脐带华通氏胶中分离出的多能干细胞 , 具有与 hBM-MSCs相似的免疫表型 。
Song等发现 hUCMSCs可能通过分泌血管生长因子 , 如HGF、血管内皮生长因子(VEGF)、血小板生长因子(PGF)、 TGF-β等促进卵巢修复 。
Zheng等研究发现hUCMSCs可通过调节神经生长因子/神经生长因子受体(NGF/ TrkA)通路减少颗粒细胞凋亡 , 进而促进卵巢功能恢复 。
推荐阅读
- 科学家预言:“未来人类将培育出所有人体器官。”
- 女子婚外性行为导致宫外孕卵巢被切除,向男子索赔17万
- 当35公分的针扎进身体
- 卵巢 干细胞可以抗衰老吗
- 神经元 iPS诱导多能干细胞引领人脑类器官新突破:迷你大脑“长眼睛”了
- 造血干细胞移植 干细胞最全的科普,拿走不谢!
- 科学家 为啥男人寿命短?科学家:雄性DNA会加速老化,但阉割使人长寿







