文章图片
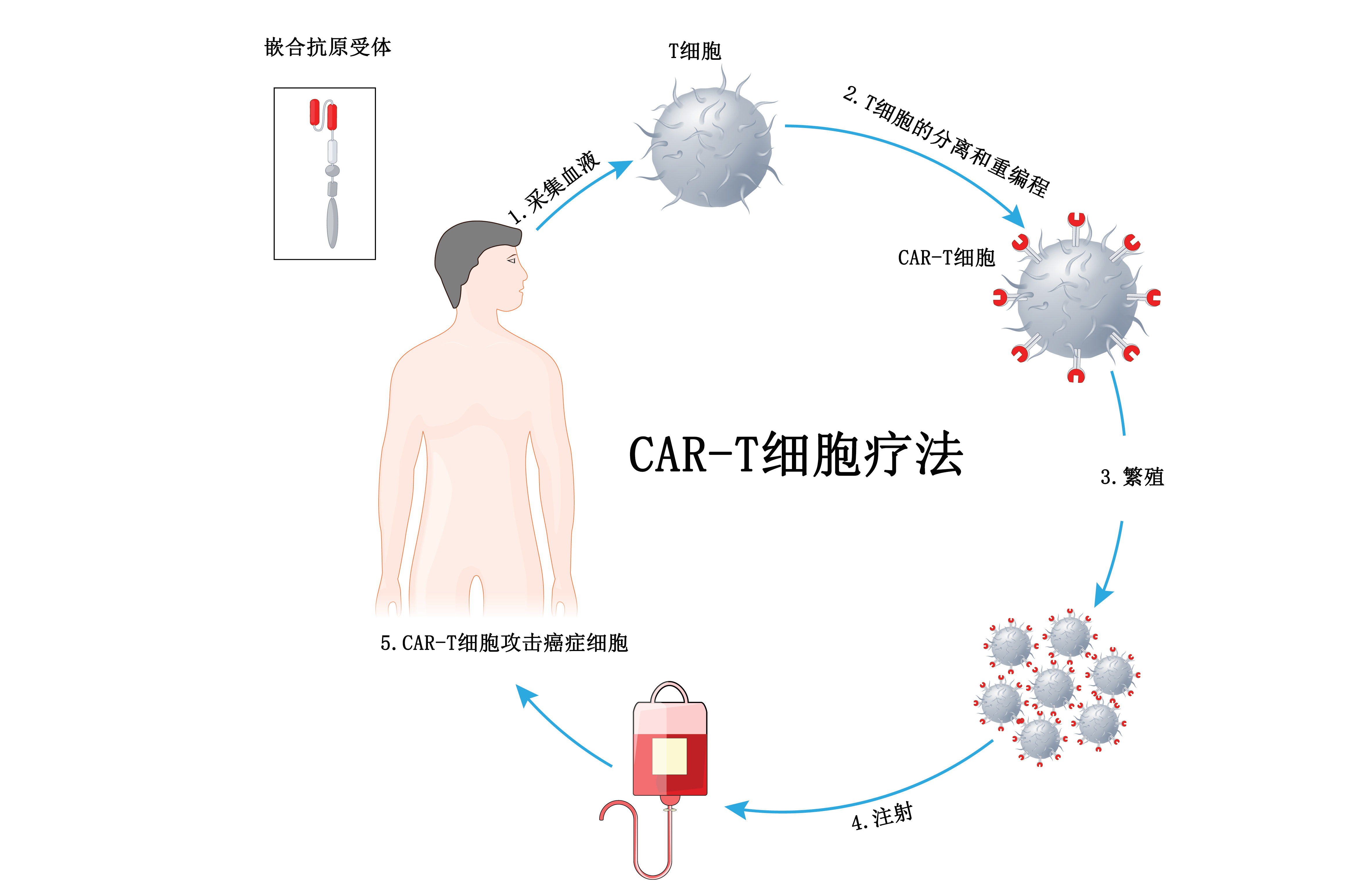
虽然滤泡型淋巴瘤通常是一种惰性类型的癌症 , 但患者可能会接受到中位数为4线的治疗 , 上限为13线 。 尽管有多种全身治疗可供选择 , 但这些方案的疗效在后期治疗中迅速下降 。 Kymriah现在在三个适应症中获得FDA批准 , 并且仍然是唯一在成人和儿童群体中获得批准的CAR-T细胞疗法 。 这种针对滤泡型淋巴瘤患者的新的有效选择可能会提供长期益处 。
诺华公司5月27日宣布 , 美国食品和药物管理局(FDA)已加速批准Kymriah(tisagenlecleucel)用于治疗经两线或多线全身治疗后的复发或难治性(r/r)滤泡型淋巴瘤(FL)成年患者 。 根据加速批准计划 , 对该适应症的继续批准可能取决于验证性试验中临床益处的验证和描述 。 早在5月初 , 该适应症已在欧盟获得批准 。
该批准是基于来自多中心、单臂、非盲2期ELARA试验(NCT03568461)的数据 。 在患有滤泡型淋巴瘤的成人中评估了Kymriah的疗效和安全性 , 这些患者在完成2个或以上全身治疗方案(包括抗CD20抗体和烷化剂)后6个月内难治或复发 , 在至少2个治疗方案后完成抗CD20抗体维持治疗期间或6个月内复发 , 或在自体造血干细胞移植后复发 。
结果显示总体应答率为86%(77/90) , 其中68%(61/90)的患者完全应答;首次应答的中位时间为2.9个月(范围为0.6至6.0个月) 。 在达到完全应答的患者中 , 85%在12个月时仍有应答 。
在中位随访21个月时可进行安全性评估的97例患者中 , Kymriah的安全性特征显著 。 根据Lee量表的定义 , 53%的患者经历了任意级别的细胞因子释放综合征(CRS) , 并且没有报告高级别(3级或更高级别)CRS病例 。 43%的患者经历了任意级别的神经系统事件;仅6%的患者出现3级或更高级别的神经系统事件 。 18%的患者(97名患者中的17名)在门诊进行输注 。
Kymriah带有关于细胞因子释放综合征和神经毒性的盒装警告 。 它只能通过名为Kymriah REMS的风险评估和缓解策略(REMS)下的受限计划获得 。
参考来源:FDA approves Novartis Kymriah? CAR-T cell therapy for adult patients with relapsed or refractory follicular lymphoma.新闻发布 , Novartis;2022年5月27日发布 。 2022年6月1日访问 。
【复发/难治性滤泡型淋巴瘤CAR-T细胞疗法Kymriah获FDA加速批准】注:本文旨在介绍医药健康研究 , 不作任何用药依据 , 具体用药指引 , 请咨询主治医师 。
推荐阅读
- 比玛雅更早的文明,在南美洲被发现,与中国人有关?
- 中国生物首席科学家张云涛:奥株新冠疫苗最快有望10月接种
- “钢铁侠战衣”能研制出来吗?科学家:克服三个问题,人人都是钢铁侠
- 人类不该遵守“一夫一妻”制?科学家提出新观点:或导致物种灭绝
- 重大发现:巴拿马猴子可能步入石器时代,地球或出现第二文明?
- 又一次震惊了!天文学家首次观测到白矮星爆炸
- 逼乎牛人提问:进化论怎么解释我经历的事件?
- 为何神农架深处被列为禁区?除“野人”外,三种神秘现象至今无解
- 动物雌性会炫耀排卵期吸引雄性,为什么人类雌性却隐藏了排卵期?







