
文章图片
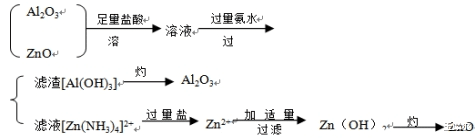
⒈ 化学方法除杂的要求
⑴ 操作方法简便易行 。
⑵ 加入的试剂只与杂质反应 , 不与原物反应 。
⑶ 除杂试剂须过量 , 以保证杂质除净 。
⑷ 过量试剂须除尽 , 以确保不引入新的杂质 。
⑸ 反应后不能带入新的杂质 。
⑹ 反应后恢复原物状态 。
⑺ 除杂途径须最佳 , 除去多种杂质时要考虑加入试剂的先后顺序 。 在多步分离过程中 , 后加的试剂应能够把前面所加入的无关物质或离子除去 。
⒉ 无机物除杂的方法实例:
⑴ 生成沉淀法:在混合物中加入某种试剂 , 使其中一种生成沉淀通过过滤而除去 , 以沉淀的形式分离出去的方法 。
例如NaCl溶液里混有少量的MgCl2杂质 , 可加入过量的NaOH溶液 , 使Mg2+离子转化为Mg(OH)2沉淀(但引入新的杂质OH-) , 过滤除去Mg(OH)2 , 然后加入适量盐酸 , 调节pH为中性 。
MgCl2+2NaOH=Mg(OH)2
+2NaCl
如除去氯化钠中的硫酸镁:把混合物溶于水 , 得到含Na+Cl-Mg2+SO42-的溶液 。 其中杂质为Mg2+和SO42- , 据此要求所加入的试剂的阳离子能与SO42-形成沉淀 , 加入试剂的阴离子能与Mg2+形成沉淀 。 故可向溶液中逐滴加入Ba(OH)2溶液至不再产生沉淀为止 , 过滤、蒸发滤液即得纯净的氯化钠 。
MgSO4+Ba(OH)2=BaSO4↓
+Mg(OH)2
⑵ 生成气体法:采用加热或加入某种试剂 , 使杂质转变为气体(通常为稀盐酸和稀硫酸) 。 例如Na2SO4溶液中混有少量Na2CO3 , 为了不引入新的杂质并增加SO42-可加入适量的稀H2SO4 , 将CO32-转化为CO2气体而除去 。
Na2CO3+H2SO4=Na2SO4
+CO2↑+H2O
再如除去氯化钠中的碳酸钠:把混合物溶于水 , 得到含Na+Cl-CO32-的溶液 , 其中杂质为CO32- 。 CO32-可通过加入适量盐酸转变为CO2除去(当然也可以使CO32-转化为沉淀除去) , 然后将溶液蒸干即得纯净的氯化钠 。
Na2CO3+2HCl=2NaCl+CO2↑
+H2O
⑶ 酸碱溶解法:利用物质与酸或碱溶液混合后反应的差异 , 用酸或碱溶液把杂质转变成液体而除去 。 如Cu粉中含有少量的Fe粉 , 可用稀硫酸或稀盐酸除去 。
Fe+2HCl=FeCl2+H2↑
如用过量的NaOH溶液可除去Fe2O3中的Al2O3
Al2O3+2NaOH=2NaAlO2
+H2O
⑷ 氧化还原法:用氧化剂(还原剂)除去具有还原性(或氧化性)的杂质例如在FeCl3溶液里含有少量FeCl2杂质 , 可通入适量的Cl2气将FeCl2氧化为FeCl3 。 若在FeCl2溶液里含有少量FeCl3 , 可加入适量的铁粉而将其除去 。
2FeCl2+Cl2=2FeCl3
⑸ 正盐和与酸式盐相互转化法:例如NaHCO3溶液中混有少量Na2CO3杂质 , 可向溶液里通入足量CO2 , 使Na2CO3转化为NaHCO3 。
Na2CO3+CO2+H2O=
2NaHCO3
⑹ 转换法:通过反应将杂质转变为被提纯的物质 。 如欲除去苯中的苯酚 , 可加入氢氧化钠 , 使苯酚转化为酚钠 , 利用苯酚钠易溶于水 , 使之与苯分开 。
欲除去HNO3中混有的少量H2SO4 , 可加适量的Ba(NO3)2除去 。
H2SO+4Ba(NO3)2=BaSO4↓
+2HNO3
除去二氧化碳气体中的一氧化碳气体:把混合气体通过灼热氧化铜充分发生反应 , 即可把一氧化碳转变为二氧化碳而除去 。
CO+CuO=(灼烧)CO2+Cu
⑺ 置换法:将混合物中的杂质与适量试剂通过发生置换反应而除去 。 常用活泼金属置换盐中的不活泼金属 , 达到除去杂质的目的 。
如除去硫酸亚铁中的硫酸铜:把混合物溶于水 , 得到含Cu2+Fe2+SO42-的溶液 , 其中杂质为Cu2+ 。 向混合溶液中加入过量铁粉 , 铁粉与Cu2+发生置换反应 , 然后过滤、蒸发结晶即得纯净的硫酸亚铁 。
Fe+CuSO4=FeSO4+Cu 。
如:硫酸锌固体中含有少量硫酸铜杂质 , 可将混合物溶解之后 , 加入适量锌粉 , 再过滤除去被置换出来的铜 , 蒸发滤液获得硫酸铜固体 。
Zn+CuSO4=ZnSO4+Cu 。
⑻ 吸收法:两种以上混合气体中的杂质被某种溶剂或溶液吸收 ,而要提纯的气体不能被吸收时 , 可用此方法 。 常用来除去气体中的杂质 。 选择适当的试剂与气体中的杂质反应即可达到目的 。 一般地 , 酸性气体用碱溶液吸收;碱性气体用酸溶液吸收;如CO中混有少量CO2时 , 可将混合气体通过盛有氢氧化钠的溶液来除去 。
CO2+2NaOH=Na2CO3+H2O
欲除去二氧化碳中混有的少量氯化氢和水 , 可使混合气体先通过饱和碳酸氢钠的溶液后 , 再通过浓硫酸 。
推荐阅读
- 基因编辑酵母菌酿啤酒!科学家称口味更好,你敢喝吗?
- 他虚构了一个星球,上面住着一群特别的生物,古怪又可爱
- 地质科学的未来发展方向主要有这么几条,工作性质很辛苦
- 北溪管道泄漏:至少8万吨甲烷!全球人“背锅”?真相似乎在出现
- 北溪管道泄漏,无人承认,对地球影响多可怕?人类要做最坏的打算
- 这就是植物的再生能力
- 北溪泄漏时管线内有8亿立方天然气
- 20万吨甲烷泄漏!北溪管道疑云重重,美国专家:应以战争罪论处
- 大气中二氧化碳的含量比地面高不了15%







