文章图片
研究并研发抑制免疫逃逸机制的乙肝新药物 , 在AASLD2022大会上被日本广岛大学等研究人员提出来 。 从人体肝细胞中以彻底清除乙肝病毒(HBV)为目标 , 全球研究人员可畏绞尽脑汁 。
乙肝开发抑制逃逸新药 , 发现其上调TRAIL-R3表达 , 逃避细胞凋亡
该研究证明了HBV在肝细胞中通过上调 TRAIL-R3 的表达 , 以逃避细胞凋亡和 TRAIL 对其复制的抑制 。 研究人员介绍 , 在慢性乙肝病毒感染中 , 即使经过强烈的宿主免疫反应之后 , 也很难从肝细胞中完全清除HBV , 人们认为乙肝病毒有一套自身的逃逸机制系统 , 该逃逸系统可以通过调节细胞内信号来应对宿主免疫反应 。
研究人员为了澄清这种免疫耐受机制 , 使用HBV感染的人源化小鼠肝脏进行基因表达分析 , 并分析其转录调控机制以及 TRAIL-R3 上调与TRAIL-诱导的细胞凋亡或HBV复制之间的关联性 。
样本来自于HBV感染以及未感染人类肝细胞嵌合的小鼠 , 采用cDNA微阵列技术和下一代测序分析方法对该样本进行基因表达分析 。 研究人员还利用到人类肝细胞嵌合小鼠和肝癌细胞系分析了 TRAIL-R3 上调在HBV感染中的意义 。
研究结果表明 , 通过cDNA微阵列技术与下一代测序法 , 肿瘤坏死因子相关凋亡诱导配体(TRAIL)受体3(TRAIL-R3)在HBV感染的人类肝细胞移植小鼠的肝脏中显著上调 。 通过体外和体内HBV复制模型验证了HBV感染对 TRAIL-R3 的诱导作用 , 并被抗病毒疗法核苷(酸)类似物治疗抑制了这种诱导 。
TRAIL-R3的转录在转录起始位点上游 -969 ~ -479 个核苷酸的 TRAIL-R3 启动子上受到调控 , 其转录通过NF-κB信号的激活受到HBx的调控 。 在 TRAIL 处理的实验中 , 调控 TRAIL 相关凋亡的cFLIPs在HBV复制模型中的表达减少 。
此外 , 研究人员进一步利用HBV感染细胞分析了HBV感染和TRAIL-R3表达之间的关系 。 在TRAIL-R3过表达的HBV感染的HepG2-NTCP细胞中 , HBV感染导致更高的TRAIL-R3表达 , 上清液HBeAg水平明显高于没有TRAIL-R3过表达的细胞 。
TRAIL不仅能诱导细胞凋亡 , 还能抑制HBV复制 。 TRAIL-R3的上调 , 既可以抑制HBV感染的肝细胞中TRAIL依赖性的凋亡 , 也可以抑制TRAIL介导的对HBV复制的抑制 。
综上所述 , 研究人员给出
小番健康结语:以上是一项早期研究 , 在今年的AASLD大会上公布出来 。 该研究是为了阐明免疫耐受机制 , 开发出乙肝病毒逃逸免疫力的新药物的早期研究进展 。
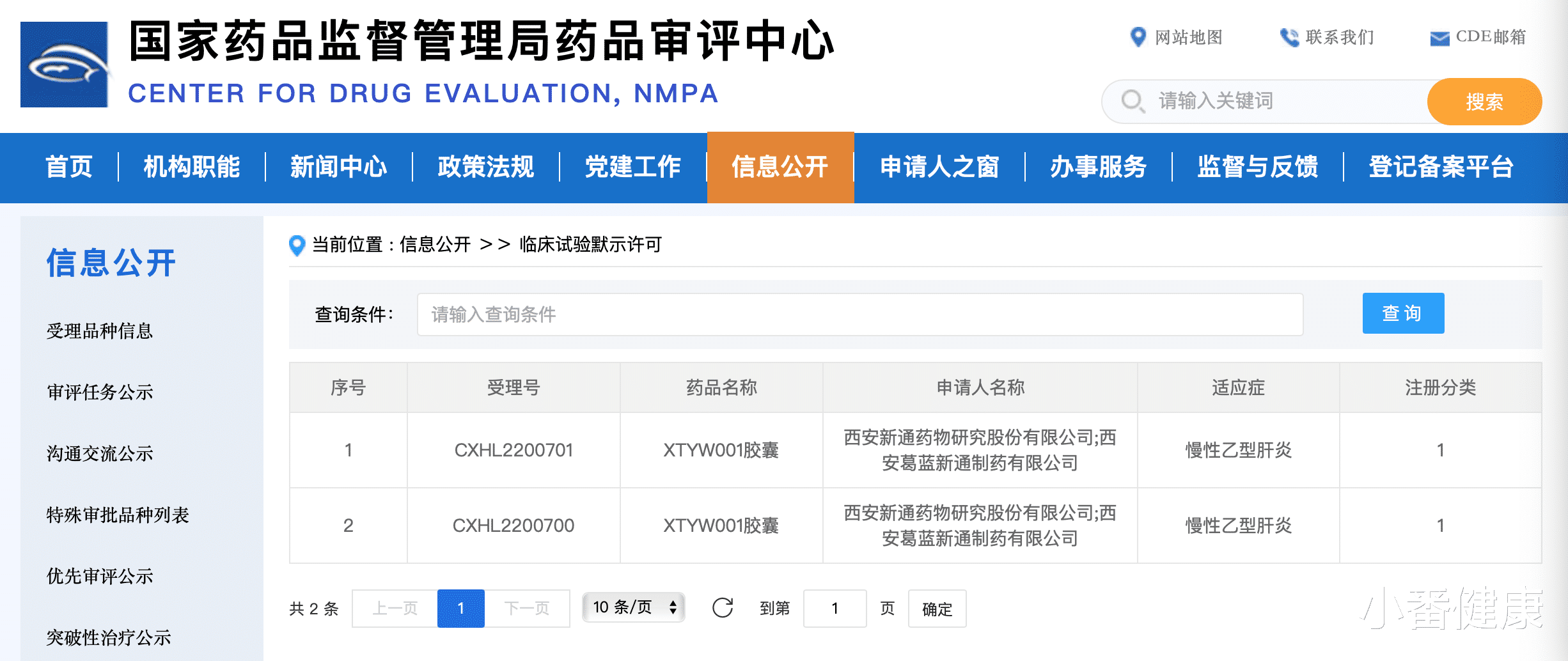
【乙肝开发抑制逃逸新药,发现其上调TRAIL-R3表达,逃避细胞凋亡】另外 , 11月26日已介绍由我国西安新通药物科学家自主研发的乙肝创新药——核衣壳蛋白装配抑制剂XTYW001胶囊 , 已向我国药品监督管理局药品评审中心(CDE)提交IND并获得受理 , 近期 , 该乙肝在研新药已经获得国家药品监督管理局药品审评中心临床试验默示许可 。
推荐阅读
- 「科普」抗原与核酸哪个更管用?核酸检测结果真实吗?
- 这年头,做核酸的都想上市
- 男子被隔离在单位上班和住宿,老婆想聊天,不料却被他经常挂断通话
- 太空会师!拥抱地球来的战友
- 给封控区的女儿送补给,证明我确实有些神经了
- 核酸造富计划,被叫停了
- 核酸检测造假问题后,越挖越离谱了,入住方舱竟然还明码标价
- 新突破!早期阿尔茨海默病治疗药物临床试验最新结果发布
- 一家人做核酸插队打反击者被公诉,父子2人打一个,挨揍的犯了罪







