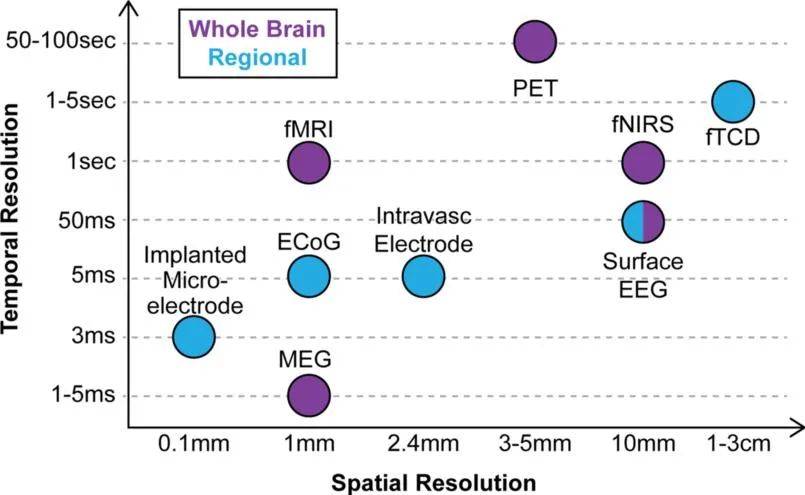
在上期的“Visikol应用之序幕篇”中展示了两类脑机接口:一类是非侵入式的 , 如为世界杯开球的“机甲”青年平托所戴的“可穿戴式”头盔 , 另一类则是侵入式的 , 像埃隆·马斯克的Neuralink公司推出的芯片Link V0.9一样 , 直接将芯片植入大脑中从而获取脑信号 。 与非侵入性方法相比 , 侵入性方法的显著优点是提供了高的时间和空间分辨率 , 提高了所获得信号的质量和信噪比[1] 。 但是侵入性方法的有一些无法忽视的缺点:可能导致组织损伤[2]、引发神经炎症反应[3]、信号记录寿命较低[4]等 。 一般而言 , 基于电极的传感器往往具有更高的时间分辨率 , 而更具侵入性的传感器往往会获得更高的时间分辨率(图1[5]) 。 在这种背景下 , 脑机接口技术的应用面临着植入物性质、侵入性水平和信号分辨率之间的权衡[3] 。 因此促进大脑和机器之间通信的神经接口需要与大脑组织兼容 , 通过生物相容性材料可促进脑相容性神经接口的发展[6] 。
文章图片
图1. 空间和时间分辨率在目前的脑机接口类型之间的差异[5]
文章图片

文章图片
研究内容
由宾夕法尼亚卡伦大学的D. Kacy Cullen科研团队在脑机接口研究中利用组织工程学方法制备“活电极”:作为工程化的神经微组织(microtissue engineered neural network , 微组织工程神经网络 , μTENN) , 活电极通过与宿主神经元形成突触 , 为神经靶细胞与脑表面之间的信号传递提供了天然的生物基质 。 当不再使用任何传统无机电极材料(例如铂、钨、硅)至大脑表面时 , 全有机物的形式可改善慢性异物反应 , 潜在地改善长期稳定性(图2J) 。 此外 , 这是一种新型的光控“活电极”:结合光遗传学(Optogenetics , 2010年被Nature Methods选为年度方法 , 同年被Science认为是近十年来的突破之一 , 近几年更是诺奖热门) , 提供进入深层神经环路的途径 , 而且病毒转导在植入前受限于μTENN神经元 , 因此不受潜在的病毒传递风险 。
“活电极”巧妙构造——利用单向/双向μTENN和光遗传学提供神经环路的输入/输出
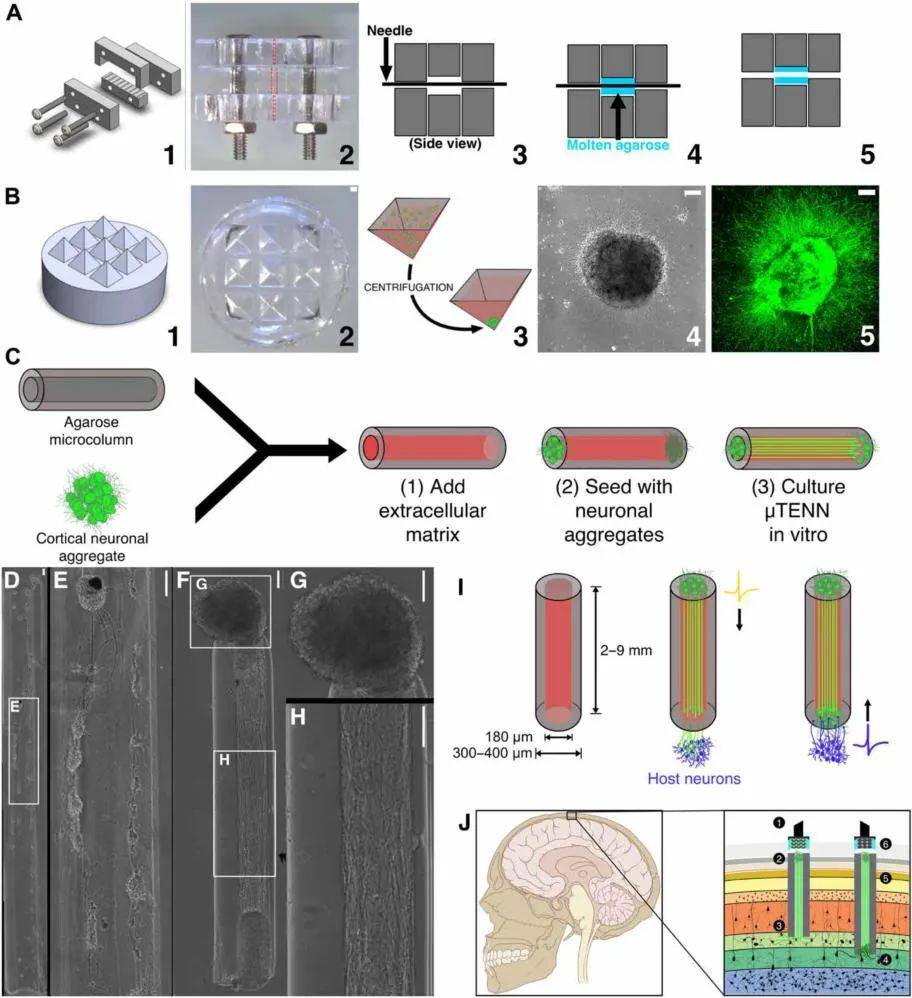
图2是“活电极”构造的概念示意图 。 μTENN构造包括水凝胶微柱、神经元培养物和细胞外基质腔 。 (A)1:可定制的亚克力模具 , 用于制备微柱;2:模具虚线顶视图表示外径(外径;中部)和内径(内径;顶部和底部);3:将匹配内径的针插入模具中:4:琼脂糖(蓝色)在微柱中熔融:5:拆针拆模后取出微柱 。 (B)1:具有锥形井的3D打印模具;2:聚二甲基硅氧烷(PDMS)浇铸的锥形井;3:分离的神经元(绿色)在锥形井中离心形成球状聚集体;4:24小时后聚集体相图;5:72小时后共聚焦对聚集体成像结果(GFP标记) 。 (C) 微柱(灰色)充满细胞外胶原层粘连蛋白基质(红色) 。 然后将神经元聚集体置于微柱末端并在体外培养生长 。 (D)用分离的神经元得到早期μTENN对最终的网络结构产生了有限的控制(E) 。 聚集体(F)表现出强大的轴突生长和更可控的结构 , 具有离散的胞体区域(G)和神经投射(H) 。 (I)左图:可植入活电极的μTENN微柱外型尺寸;中间:单向突触宿主神经元(紫色) , 传递外部信号至目标皮层区域;右:宿主神经元突触双向μTENN , 传递来自宿主皮层的活动 , 可通过背侧μTENN进行监测 。 (J) 作为可移植输入/输出通道的光遗传学工程“活电极” 。 输入:LED阵列(1)通过光学刺激一个单向的、通道视紫红质阳性μTENN(2)激活第四层神经元(3) 。 输出:第五层神经元(4)突触一个双向μTENN(5);传递神经元的活动被记录于位于大脑表面的光电二极管阵列(6) 。 比例尺 , 100μm 。
文章图片
图2. “活电极”构造的概念示意图[7]

文章图片
光刺激、钙成像和光记录
作为对“光控活电极”方法的概念验证 , D. Kacy CullenCullen团队建立了一个“全光”范式 , 能够在体外同时对μTENN聚集体进行光遗传学控制和光学监测 。 用通道视紫红质-2(ChR2)转导皮层神经元聚集体以进行基于光的神经元激活(“输入”) , 用遗传编码的荧光钙reporter RCaMP1b通过AAV1转导以进行神经元活动的光学读出(“输出”) 。
【神经|Visikol透明化应用之光控“活电极”脑机接口】以下视频显示了大约6mm长的ChR2/RCaMP μTENN的聚合体 , 在光刺激/光记录实验成像结果 。 右上角红色箭头表示在470nm处ChR2+聚集体(视野外)的光学刺激 。 脉冲光纤输出功率分别为106、211、317、423、528和634 mW/mm2(视频1-6) 。 RCaMP+荧光的增加可以看作是随着脉冲强度的增加而增加 。

文章图片
106 mW/mm2

文章图片
211 mW/mm2

文章图片
317 mW/mm2

文章图片
423 mW/mm2

文章图片
528 mW/mm2

文章图片
634 mW/mm2
视频1-6. “活电极”μTENN光刺激/光记录实验成像结果
生物相容、功能性“活电极”——常规免疫组化方法结合Visikol组织透明化
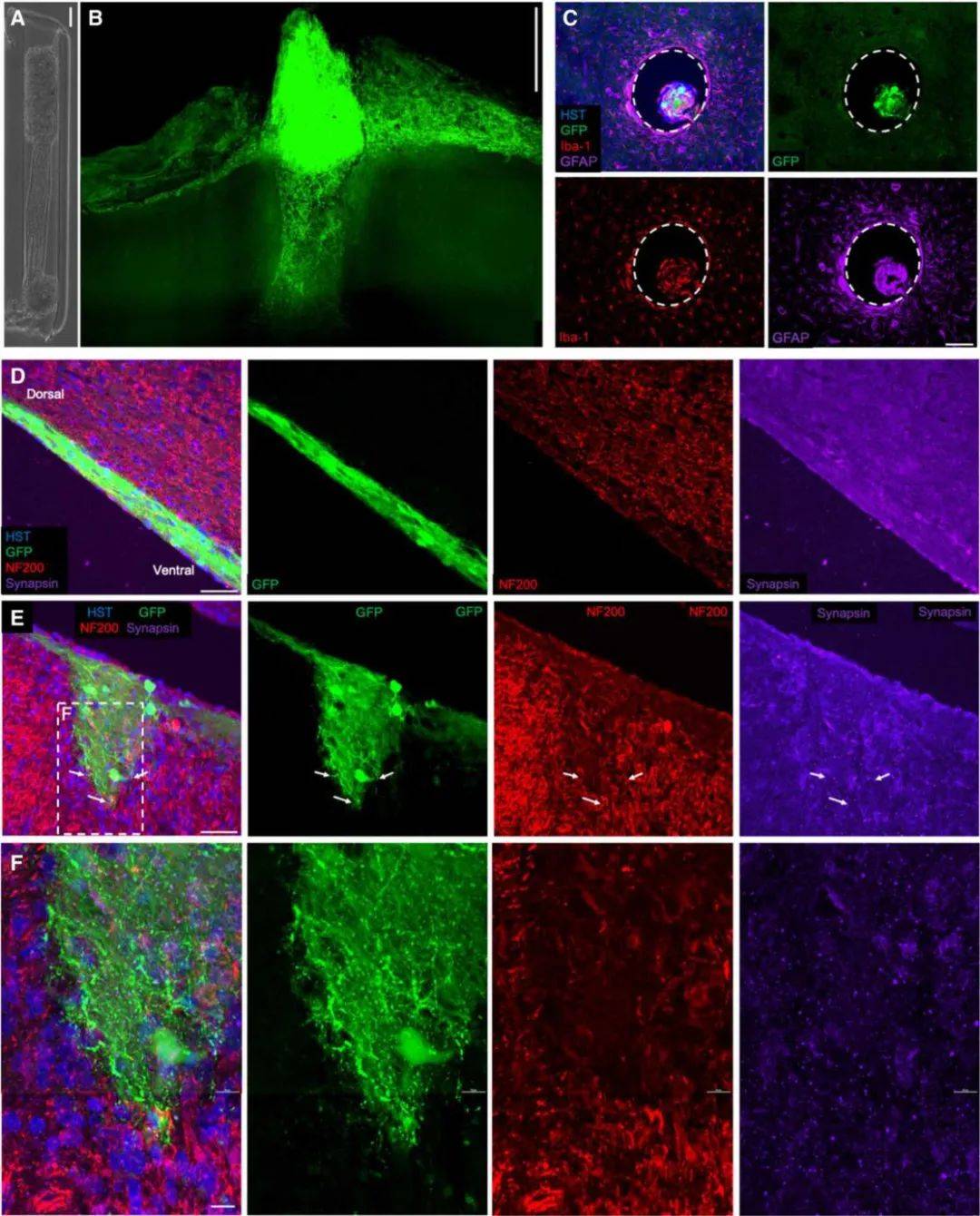
植入式神经接口的基本设计目标是维持体内的长期功能[3] 。 可能遇到的障碍中较普遍的可以概括为对植入物的多模式、持续的排异反应(foreign body response , FBR) , 随着时间的推移 , 这种反应会降低脑机接口的效能[8] 。 FBR是一种对健康组织破坏和大脑中持续存在异物的神经炎症反应 , 植入物在大脑中的存在通常会引起持续的炎症反应 , 星形胶质细胞和小胶质细胞都会以促炎状态留在该区域 , 试图消除异物[9,10] 。 而文章中星形胶质细胞增生和小胶质细胞增生的标记物染色显示 , 只有适度的宿主炎症反应(图3C) 。
图3显示在小鼠脑内植入μTENN 1周和1个月 , 组织透明化和切片免疫组织化学结果 。 其中 , μTENN神经元存活并维持预先形成的胞体-轴突结构 , 其中GFP+/GCaMP+胞体主要定位于微柱终端并由轴突束跨越(图6) 。 为了观察植入1个月的炎症反应程度 , 对植入物组织切片进行小胶质细胞/巨噬细胞(Iba-1 , 红色)和星形胶质细胞(GFAP , 玫红色)染色 , 显示只有少量的宿主神经炎症反应(图6C) 。 在植入的背侧区域发现大量密集的GCaMP+胞体(图6B) , 管腔内的轴突和树突横跨微柱(图6D) 。 观察到背侧聚集体沿脑表面或沿微柱进一步扩散 , 推测是由于细胞从聚集体迁移而增加与宿主组织的相互作用(图6B) 。 在某些情况下 , 从腹侧植入物的位置也有高达数毫米的神经元迁移 , 尽管迁移的存在和程度因植入物而异 。 总的来说 , 在活体电极的腹侧聚集体中有广泛的神经突起生长 , 并有结构证据表明与宿主神经元形成突触(图6E和F) 。 箭头表示穿透宿主大脑的十个神经突起和假定的突触形成 , 虚线表示放大(F) 。 比例尺 , 100μm(A至C)、50μm(D和E)和10μm(F) 。 HST , Hochest 。
文章图片
图3. μTENN免疫组化结果和Visikol组织透明化成像
简便、效率的Visikol透明化方法
其中经采用振动切片的方式采集到的100-200um切片至2mm厚切片 , 均由Visikol透明化 , 采用简单的梯度脱水后 , 即可直接使用Visikol HISTO透明化试剂 , 2mm厚切片简单浸泡4小时(Visikol HISTO-1、HISTO-2分别孵育2小时)即可成像 , 可解决由于组织光散射特性而限制对超过几百微米深的神经元成像观察问题 。 Visikol HISTO试剂专为生物大样品透明化而设计 , 适用于厚度超过1mm的样品 , 且不需要去除细胞膜脂质 , 因此保留了固有的细胞结构(亲脂性染料适用) , 兼容免疫染色 , 此外透明化结果可逆 , 可继续进行相关组学研究 。
目前Visikol系列产品 , 不仅有用于完整动物组织的透明化试剂 , 还有可用于3D细胞培养模型透明化、动物胎儿骨成像、以及植物样本透明化等样本 , 适用的样本种类多 , 可应对广大科研工作者各类研究需求 。
公司官网:Visikol透明化应用之光控“活电极”脑机接口
参考文献
[1] Abdulkader, S. N. , Atia, A. , & Mostafa, M. S. M. . (2015). Brain computer interfacing: applications and challenges. Egyptian Informatics Journal, 16( 2), 213-230.
[2] Kawala-Sterniuk A, Browarska N, Al-Bakri A, et al. Summary of over Fifty Years with Brain-Computer Interfaces-A Review. Brain Sci. 2021;11(1):43.
[3] Grill WM, Norman SE, Bellamkonda RV. Implanted neural interfaces: biochallenges and engineered solutions. Annu Rev Biomed Eng. 2009;11:1-24.
[4] Kirsch RF, Ajiboye AB, Miller JP. The Reconnecting the Hand and Arm with Brain (ReHAB) Commentary on "An Integrated Brain-Machine Interface Platform With Thousands of Channels". J Med Internet Res. 2019;21(10):e16339.
[5] Martini ML, Oermann EK, Opie NL, Panov F, Oxley T, Yaeger K. Sensor Modalities for Brain-Computer Interface Technology: A Comprehensive Literature Review. Neurosurgery. 2020;86(2):E108-E117.
[6] Jeong YC, Lee HE, Shin A, Kim DG, Lee KJ, Kim D. Progress in Brain-Compatible Interfaces with Soft Nanomaterials. Adv Mater. 2020;32(35):e1907522.
[7] Adewole DO, Struzyna LA, Burrell JC, et al. Development of optically controlled "living electrodes" with long-projecting axon tracts for a synaptic brain-machine interface. Sci Adv. 2021;7(4):eaay5347.
[8] Tresco PA, Winslow BD. The challenge of integrating devices into the central nervous system. Crit Rev Biomed Eng. 2011;39(1):29-44.
[9] Harris JP, Tyler DJ. Biological, mechanical, and technological considerations affecting the longevity of intracortical electrode recordings. Crit Rev Biomed Eng. 2013;41(6):435-456.
[10] Woeppel K, Yang Q, Cui XT. Recent Advances in Neural Electrode-Tissue Interfaces. Curr Opin Biomed Eng. 2017;4:21-31.
推荐阅读
- 技术|“2”类医械有重大进展:神经介入产品井喷、基因测序弯道超车
- 重大进展|“2”类医械有重大进展:神经介入产品井喷、基因测序弯道超车
- 地铁|信号女子突击队:巧手“绣”出铁路“神经网”
- 模型|神经辐射场去掉「神经」,训练速度提升100多倍,3D效果质量不减
- 神经元|大脑模式分离机制有了新发现
- 神经元|为什么你会亲近黑猫而逃离黑豹 大脑模式分离机制有了新发现
- 函数|NeurIPS 2021 | 华为诺亚Oral论文:基于频域的二值神经网络训练方法
- 小胶质细胞|验证大脑神经细胞再生疗法 有三个基本原则
- 人工智能|计算神经科学家、IMAGEN之父冈特·舒曼已全职加盟复旦
- 量子力学|神经网络打开理解电子相互作用新窗口







