自噬简介
自噬(autophagy=self-eating)意为自体吞噬 , 是真核细胞在自噬相关基因(autophagy related gene , Atg)的调控下利用溶酶体降解自身细胞质蛋白和受损细胞器的过程 。 自噬可防止细胞损伤 , 促进细胞在营养缺乏的情况下存活 , 并对细胞毒性刺激作出反应 。 自噬包括生理条件下的基础型自噬和应激条件下的诱导型自噬 。 前者是细胞的自我保护机制 , 有益于细胞的生长发育 , 保护细胞防止代谢应激和氧化损伤 , 对维持细胞内稳态以及细胞产物的合成、降解和循环再利用具有重要作用;但自噬过度可能导致代谢应激、降解细胞成分 , 甚至引起细胞死亡等 。 研究表明 , 自噬能在细胞稳态、衰老、免疫、肿瘤发生及神经退行性疾病等多种生理病理过程中发挥重要作用 。
根据包裹物质及运送方式的不同可将自噬分为3种类型:
①巨自噬(macroautophagy):通过形成具有双层膜结构的自噬体(autophagosome)包裹胞内物质 , 最终自噬体与溶酶体融合 。 一般情况下所说的自噬是指巨自噬 。
②微自噬(microautophagy):通过溶酶体或液泡表面的形变直接吞没特定的细胞器 。
③分子伴侣介导的自噬(chaperone-mediated autophagy, CMA):具有KEFRQ样基序的蛋白在HSP70伴侣的帮助下 , 通过LAMP-2A转运体转运到溶酶体 。
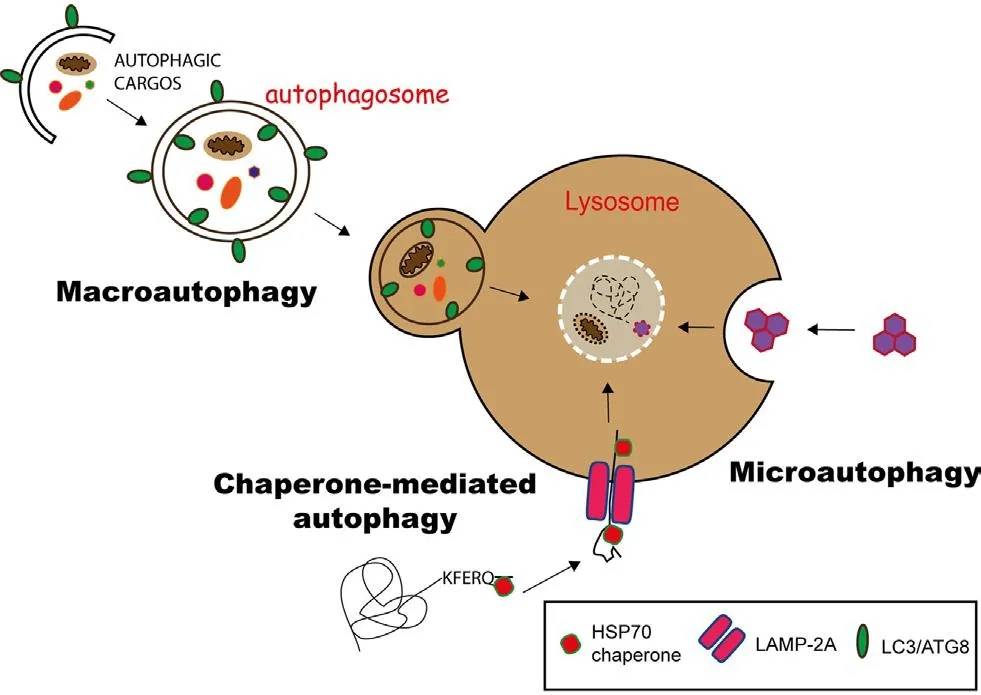
文章图片
图1. 3种自噬途径(Duraes Fernanda V et al. Front Immunol, 2015)
自噬的发生过程
自噬的本质其实是细胞内的膜重排 , 其发生过程大体分为以下4个阶段:自噬的起始→ 隔离膜和自噬体的形成→ 自噬体与溶酶体融合→ 自噬体的裂解(图2) 。
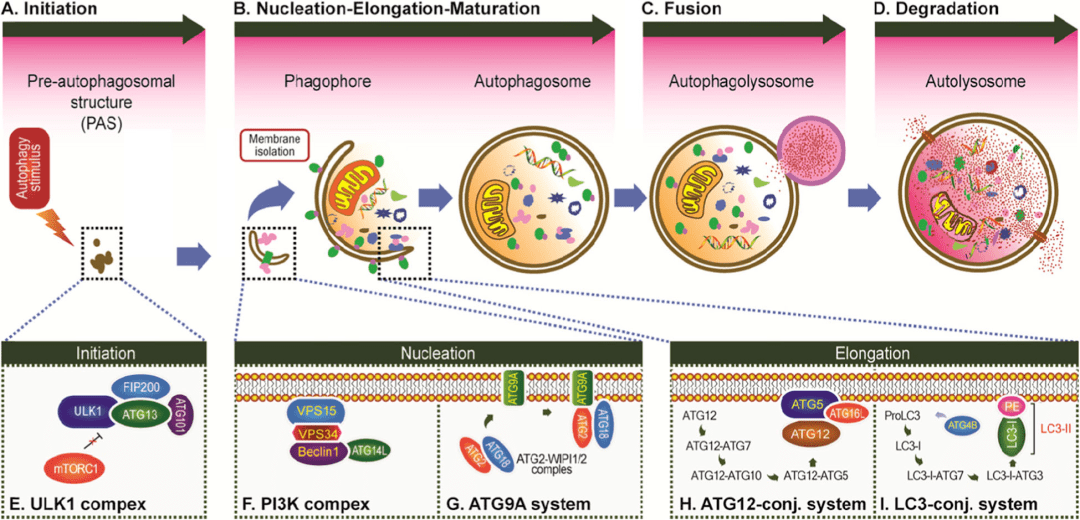
文章图片
图2. 自噬的发生过程(Li et al. Molecular Cancer, 2020)
自噬相关蛋白
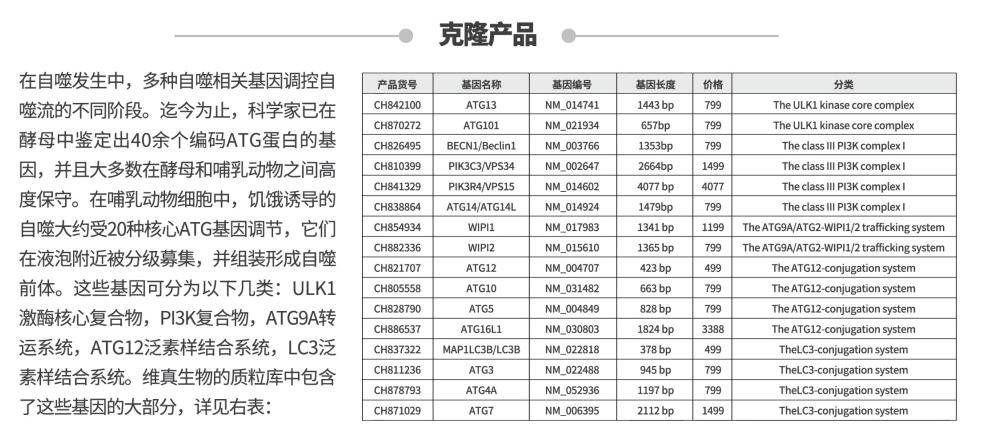
在自噬的发生过程中 , 有多种自噬相关蛋白可调节和控制自噬形成的不同阶段 。 迄今为止 , 科学家已在酵母中鉴定出40余个编码ATG蛋白的基因 , 并且大多数在酵母和哺乳动物之间高度保守 。 在哺乳动物细胞中 , 饥饿诱导的自噬大约受20种核心ATG基因调节 , 它们在液泡附近被不断募集 , 并组装形成自噬前体 。 这些基因的分类和作用(图3)如下:
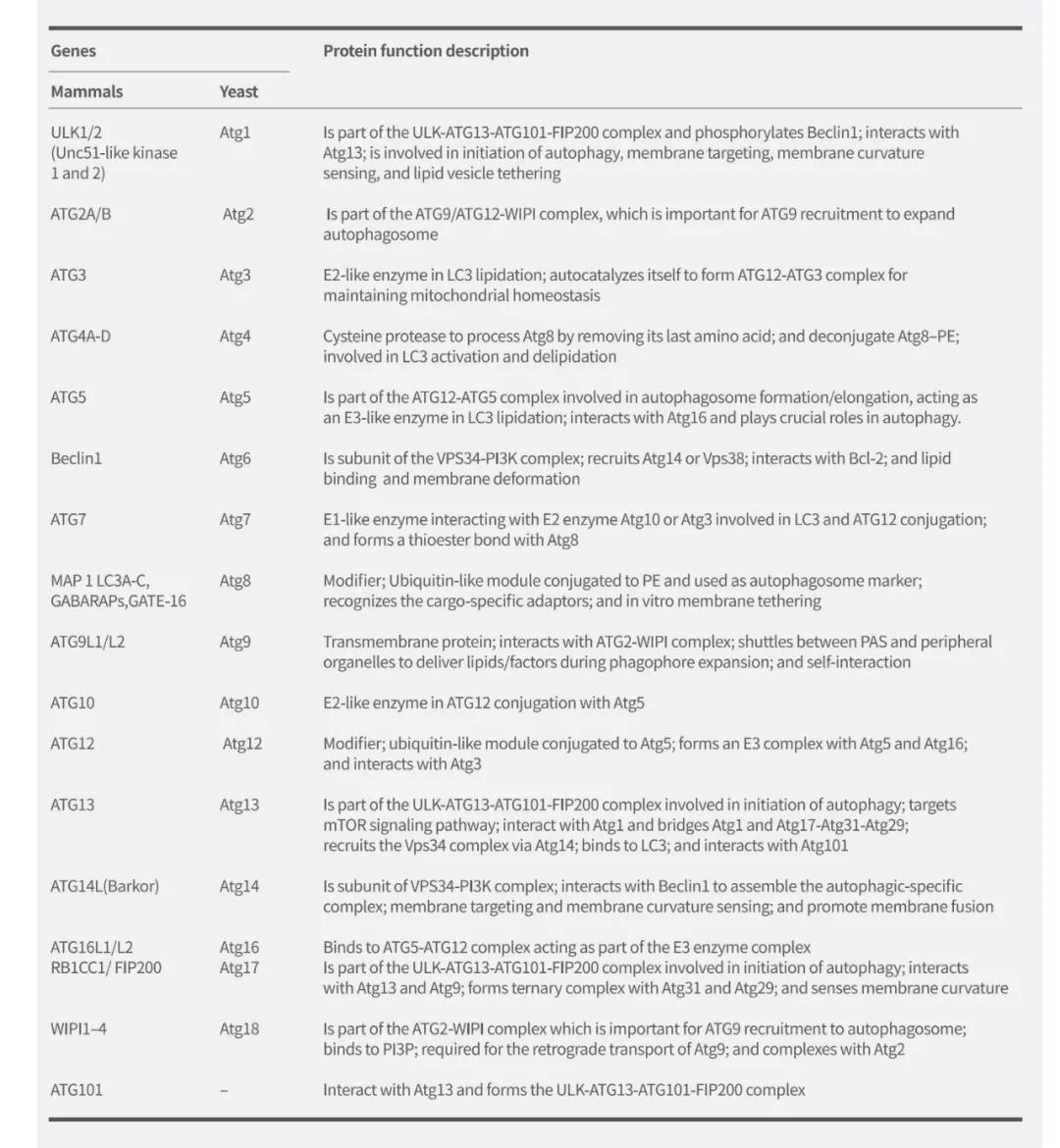
文章图片
图3. 自噬相关基因及其在自噬中的蛋白质功能(Li et al. Molecular Cancer, 2020)
自噬的调控
细胞基础水平的自噬活性很低 , 不适于观察 , 因此 , 对自噬研究多需人工干预 。 目前常用的自噬激动剂有Rapamycin和EBSS等 , 常用的自噬抑制剂有Chloroquine、3-MA、NH4Cl和 Bafilomycin A1等 。 这些自噬激动剂和抑制剂可以分别激活/抑制自噬发生的不同阶段 , 可以根据实验需要选择合适的激动剂或抑制剂 。 更多自噬调控药物见图4 。
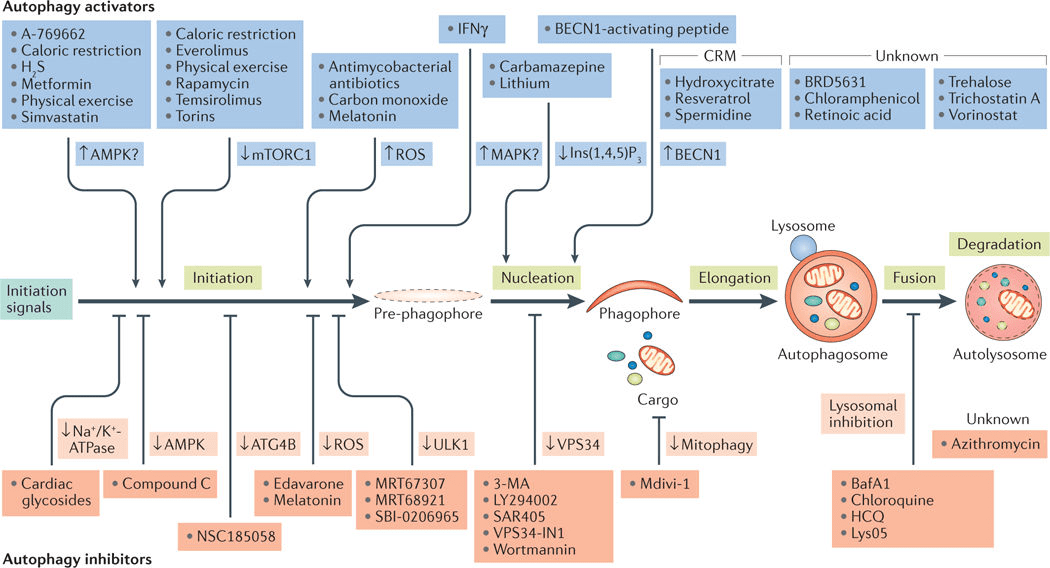
文章图片
图4. 自噬通路调控药物(Lorenzo Galluzi et al. 2017)
自噬的检测方法
在生理条件下 , 细胞自噬活性通常较低 。 但在饥饿、缺氧和疾病等刺激下会显著上调 。 另外 , 自噬抑制也与某些疾病相关 , 如癌症、神经退行性疾病等 。 选择理想的检测方法对于自噬研究至关重要 。 常用的观察和检测方法有∶
1、透射电镜法
自噬体属于亚细胞结构 , 普通光镜下看不到 , 直接在透射电镜下观察自噬不同阶段的形态变化是一种非常直接的方法 。

文章图片
表1. 自噬各阶段的形态学特征
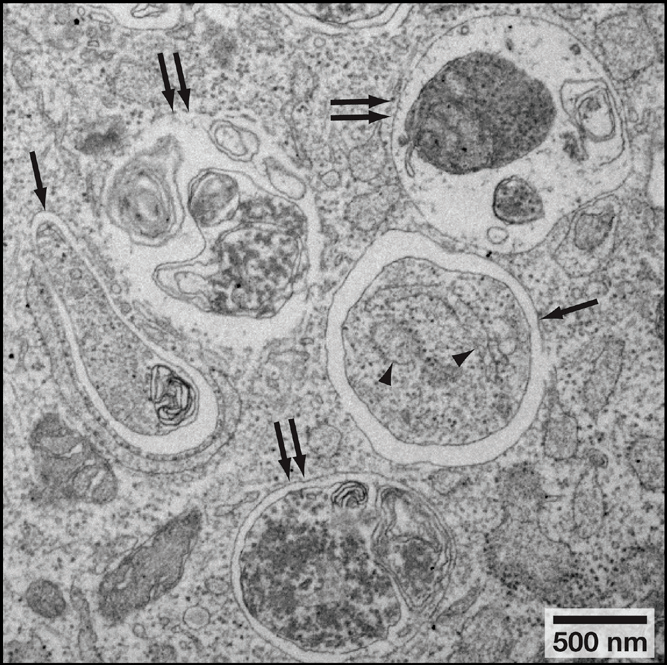
文章图片
图5. 自噬小体和自噬溶酶体形态(Noboru, Mizushima et al. Cell, 2010)
2、荧光显微镜观察法
LC3全称MAP1LC3, 贯穿整个自噬过程 , 是目前公认的自噬标记物 。 哺乳动物的LC3可分为三种:LC3A、LC3B和LC3C 。 其中 , LC3B应用广泛 。
LC3蛋白合成后被Atg4剪切掉C端5肽 , 暴露甘氨酸残基 , 产生胞浆定位的LC3-I 。 在自噬过程中 , LC3-I会被包括Atg7和Atg3在内的泛素样体系修饰和加工 , 与磷脂酰乙醇胺(PE)相偶联 , 形成LC3-II并定位于自噬体内外膜上 。 自噬体和溶酶体融合后 , 外膜上的LC3-II被Atg4切割 , 产生LC3-I循环利用;内膜上的LC3-II被溶酶体酶降解 , 导致自噬溶酶体中LC3含量很低(图6) 。 因此 , 可以通过荧光显微镜观察内源性LC3或GFP-LC3 , 实现对自噬发生的检测 。
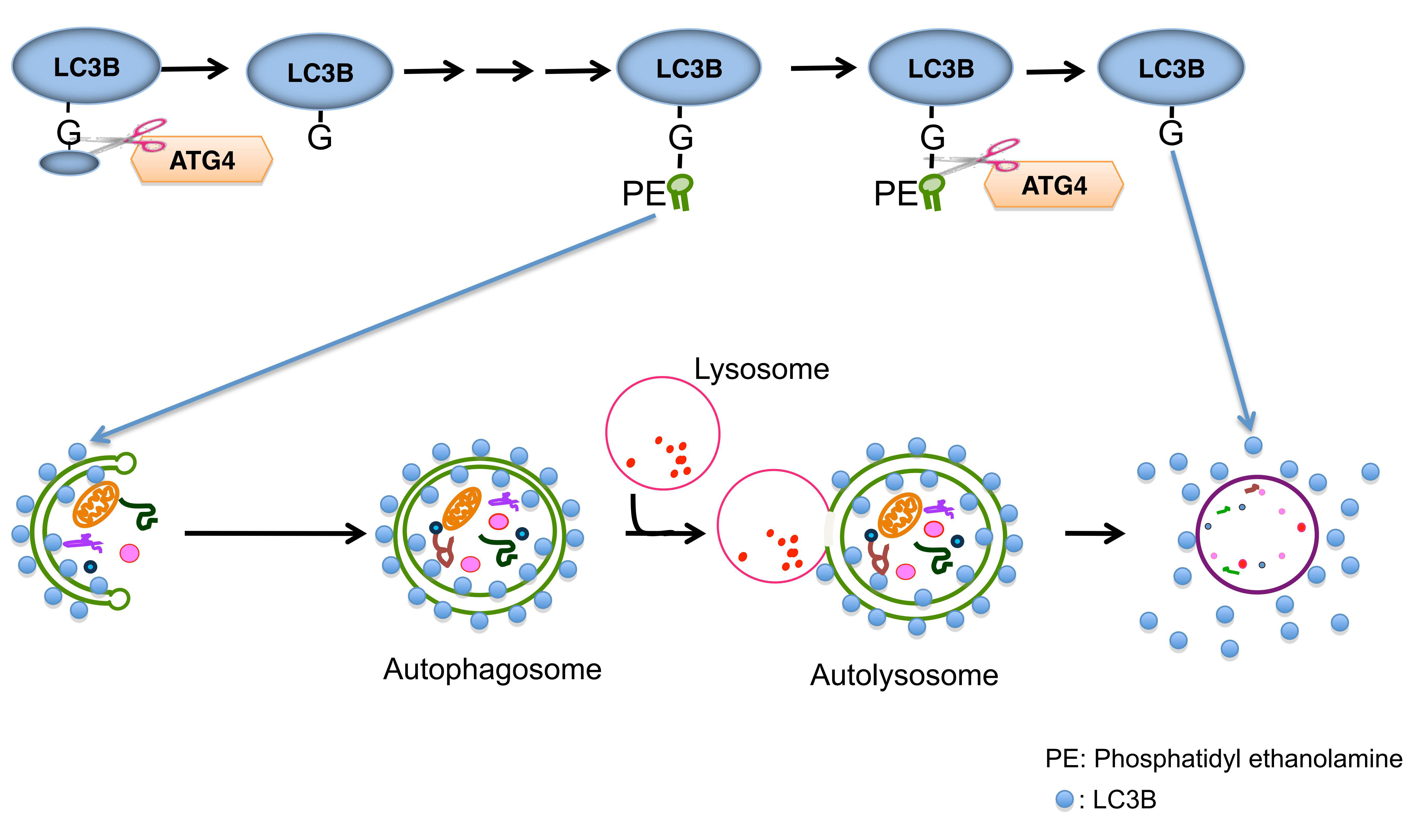
文章图片
图6. LC3在自噬发生中的路径
(Kiriyama Y et al. International Electronic Conference on Medicinal Chemistry, 2016)
GFP-LC3单荧光和mCherry-GFP-LC3双荧光指示系统
自噬形成时 , GFP-LC3或mCherry-GFP-LC3融合蛋白转移至自噬体膜 , 在荧光显微镜下形成多个明亮的绿色或黄色荧光斑点 。 当自噬溶酶体形成后 , 酸性环境使GFP荧光淬灭 , 而mCherry荧光不受影响 , 自噬溶酶体呈现红色荧光(图7) 。 因此 , 可以通过LC3荧光指示系统来监测自噬流 。
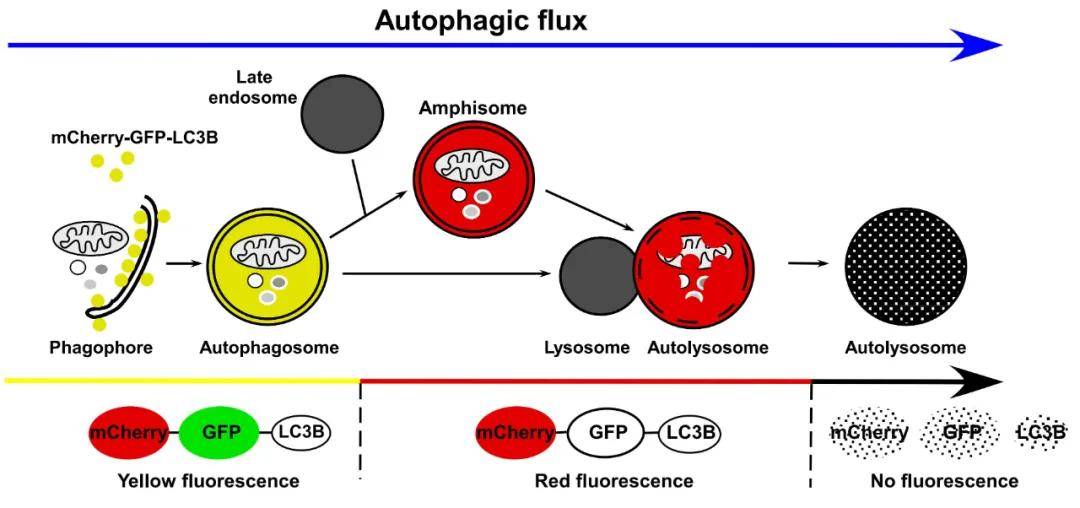
文章图片
图7. LC3自噬双标系统追踪自噬流不同阶段
(Hansen T E, Johansen T. BMC Biology, 2011)
3、Western Blot检测LC3和p62蛋白的表达量
① 利用Western Blot检测LC3-II/I比值的变化评价自噬形成(图8) 。 自噬形成时 , 胞浆型LC3-I会酶解掉一小段多肽 , 随后跟PE结合转变为膜型的LC3-II 。 因此可以通过LC3-II/I比值的大小估计自噬水平的高低 。
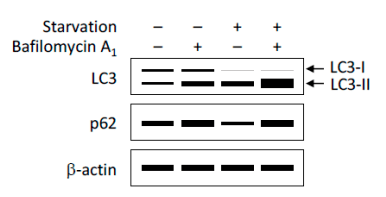
文章图片
图8. WB检测自噬通量示意图
(Yoshii, S.R. and N. Mizushima. Int J Mol Sci, 2017)
② 除LC3外 , 其他自噬底物表达量的变化也可以用于监测自噬流 。 其中 , p62是研究广泛的一个自噬底物 。 在自噬体形成过程中 , p62作为链接LC3和聚泛素化蛋白之间的桥梁 , 被选择性地包裹进自噬体 , 之后被自噬溶酶体中的蛋白水解酶将其降解(图9) , 所以p62蛋白的表达量与自噬活性呈现负相关 。 因此 , 利用Western Blot检测p62蛋白的表达量也可以评价自噬水平 。
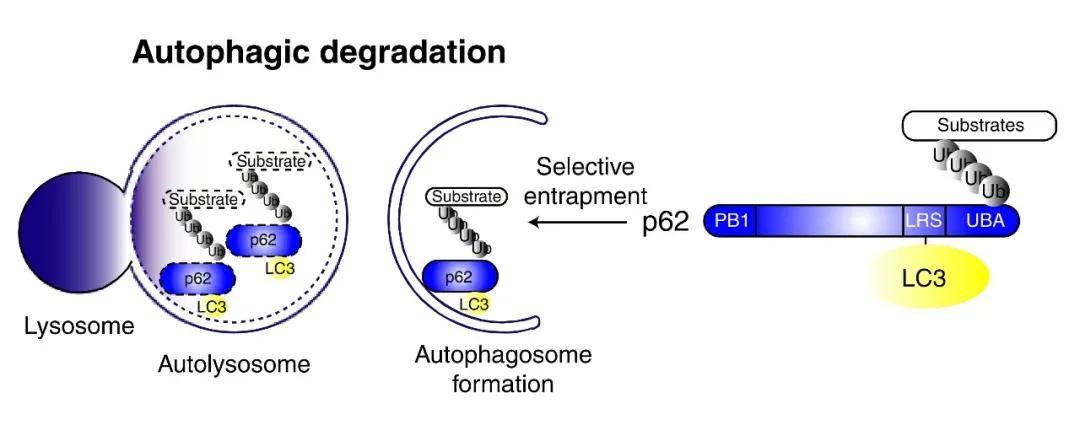
文章图片
图9. p62介导的选择性自噬模型(Ichimura Y et al. J Biol Chem, 2008)
4、基于Keima蛋白的自噬评价
Keima是一种pH敏感型荧光蛋白 , 利用它在中性和酸性pH中荧光信号不同的特性 , 可以直观地反映自噬程度 。 将细胞质的Keima传递到溶酶体可反映非选择性自噬 , 将Keima融合到特定的蛋白(如融合到线粒体靶向序列—mt-Keima)可用于反映选择性自噬 。 值得注意是 , 基于keima的检测不能在固定细胞中进行 , 因为这种检测完全依赖于溶酶体的酸性 。
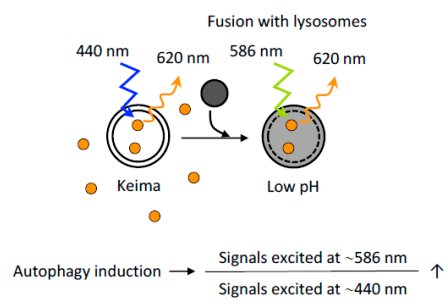
文章图片
图10. 基于Keima蛋白的自噬评价
(Yoshii, S.R. and N. Mizushima. Int J Mol Sci, 2017)
文章图片
【Atg|关于『细胞自噬』,看这一篇就够了!】
文章图片
推荐阅读
- 虚拟|比尔·盖茨关于2022年的五项预言之二:元宇宙成有用的工具
- 诊断|比尔·盖茨关于2022年的五项预言之三:家庭医疗诊断手段普及
- 网友|重磅!2021年度『量化』关键词揭榜
- 接线|关于室外监控立杆摄像机安装及立杆规范【详细说明】
- 公司|盛视科技股份有限公司 关于取得授予发明专利权通知书的公告
- 手机|刘作虎真情流露:关于ColorOS有一些话想对大家说
- Hunting|微软发布关于 Active Directory 权限提升攻击的警告
- 原文|『新』科技『星』力量 2021年度科技奖项评选报名开启
- 榜单|2021『量化关键词』揭秘中···
- 的作用|关于疫苗加强针、奥密克戎毒株…… 钟南山最新判断!







