新浪科技综合|德尔塔病毒为啥这么毒?轻松读懂变强秘密
来源:“十点科学”微信公众号
病毒变异给全球防疫不断带来一轮轮新的挑战 。 变强之后的病毒 , 到底哪里不一样了?
文章图片
图1/6
德尔塔变异株已在全球132个国家蔓延|news.cgtn.com
撰文/徐斯佳 (<日>京都大学医学院)
最近 , 新冠病毒德尔塔(Delta)变异株在国内的跨省传播引发高度关注 。 其实该病毒在全球范围内已经传播很长时间了 。
德尔塔变异株病毒载量高、传播能力强、传播速度快 , 转阴时间长 。 自2020 年10 月首次在印度出现以来 , 11个月的时间内已扩散至全球132个国家地区 , 导致多国新冠病例激增 , 对未接种疫苗人群的健康和全球经济复苏产生严重影响 。 (联合国7月30日数据)
世界卫生组织流行病学家Maria van Kerkhove指出 , 德尔塔变异株的传染力比2019年底首次出现的原始毒株高出约50% 。
德尔塔变异株为何传染性这么强?现有的疫苗还能保护我们吗?
新冠病毒是怎么变异的
生物的亲代和子代之间总有些差异 , 这是群体多样性和进化发展所必须的 。 病毒虽然是自己复制自己 , 在此过程中基因也会发生频繁的突变 , 产生变异株 。 这种突变原本是随机的 , 效果也不确定 。 有些可能不会令病毒产生明显变化;有些反而会使病毒变得更温和;自然 , 也有一些会令病毒的传播力、毒性都更强 。
所谓“适者生存” 。 如果某些变异能让病毒更容易感染宿主 , 或逃避免疫系统的攻击 , 就有更多机会大量复制 , 产生同样狡猾或强势的子代 。 然后像滚雪球一样 , 队伍不断壮大 , 对公共卫生造成新的威胁 。
其实这种现象在病毒世界里普遍存在 。 一个典型例子就是艾滋病病毒HIV 。 正是因为HIV极高的突变率 , 令疫苗和治疗药的研发非常艰难 。 精心设计的作用靶点(即反应位置)很容易因病毒变异而失去预期效果 。
再说回新冠病毒 。 我们知道 , 它们感染人体细胞的关键就是其表面的刺突蛋白(Spike Protein) ,一般有24~40个 , 呈任意排列 。 它们像一把把“钥匙” , 锚定细胞上的“锁”(受体分子)进入人体细胞 , 大肆复制、造成伤害 。 刺突蛋白也是疫苗研发的重点目标 。
刺突蛋白的底部有像关节一样的“铰链”结构 , 又能令其灵活摆动、旋转 , 增加蛋白与细胞接触的机会;而蛋白顶端有多个与细胞结合的关键部位:受体结合域(RBD) 。 危险的变异株多在这里发生重要突变 。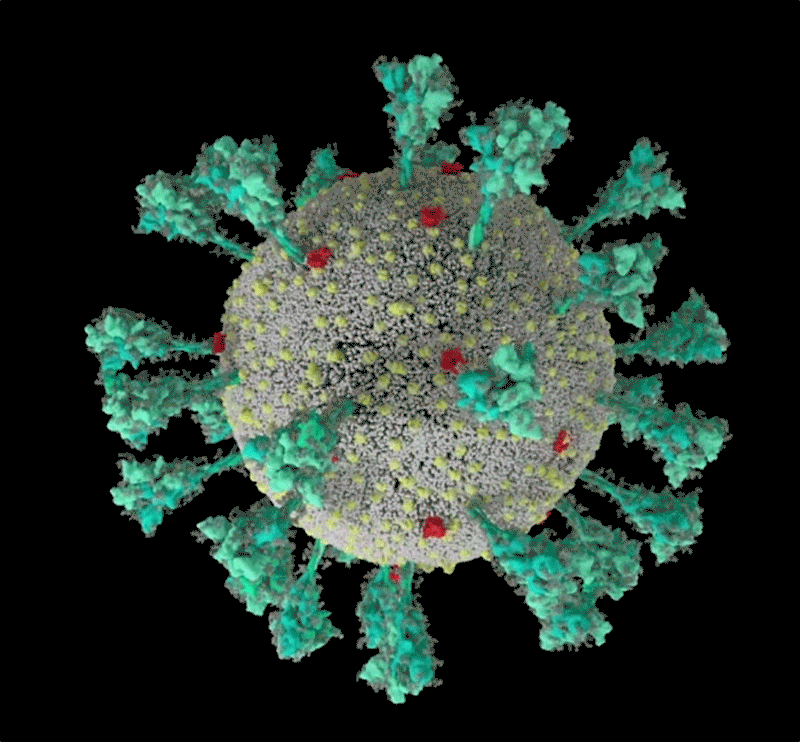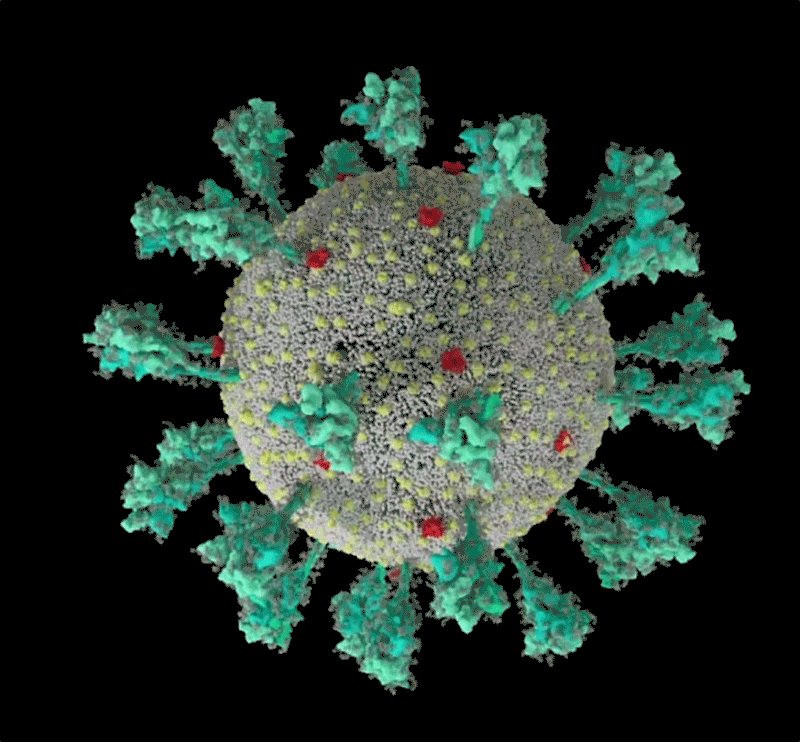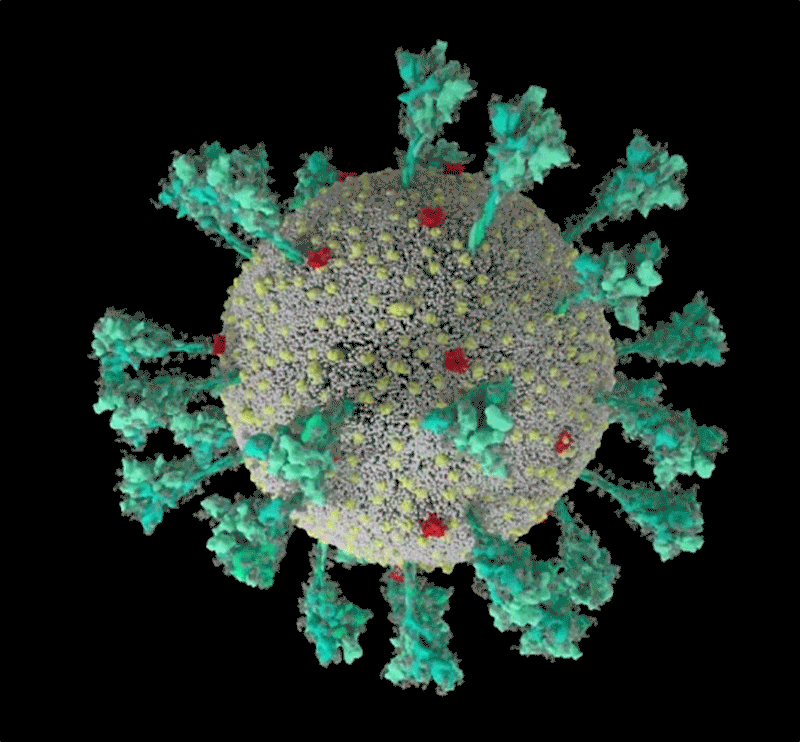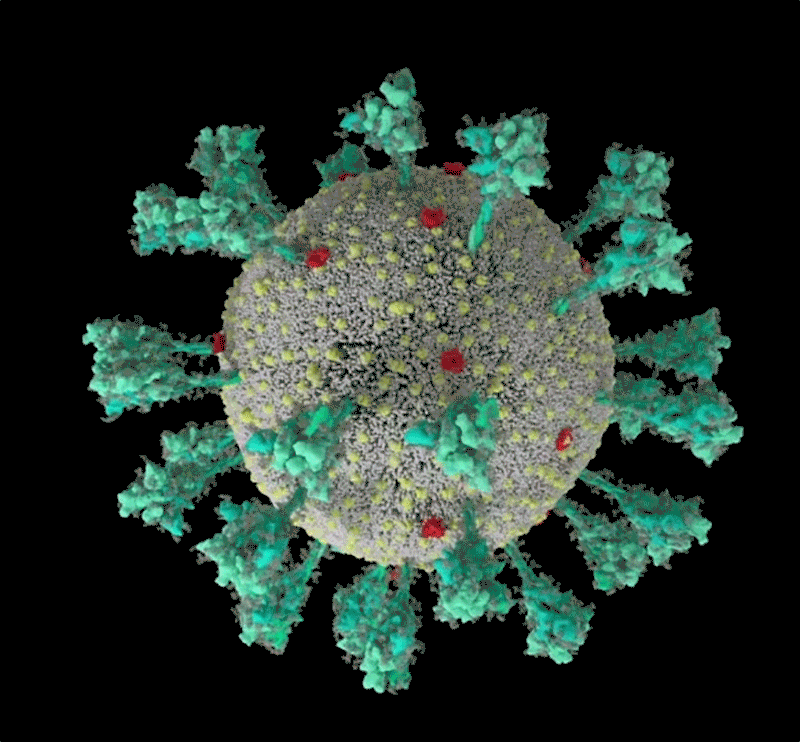
文章图片
图2/6
新冠病毒的计算机模拟结构 ,绿色即为刺突蛋白 。 可以看出其形态非常多变 , 这让它与人体细胞结合的方式也更加多样 。 | University of Utah
“传染王”德尔塔有何特别之处
根据危险程度不同 , 世卫组织将新冠变异毒株分成两类:令人担忧的变异株(VOC ,variant?of?concern)和值得关注的变异株(VOI ,variant?of?interest) 。 前者是指引发的病例多、范围广 , 并已有数据证实其传播能力、毒性强 , 或导致疫苗和临床治疗有效性降低;后者则是虽在世界范围内出现社区传播病例 , 但尚未形成大规模传染 。
显而易见 , VOC对公共健康威胁较大 , 是需要重点应对的类型 。 其中包括:在英国占主导的阿尔法变异株(Alpha)、南非的贝塔(Beta)、巴西的伽马(Gamma)和在印度率先发现的德尔塔(Delta) 。 按希腊字母命名的做法 , 是为了避免对变异株发现的国家造成污名化 。
刺突蛋白顶部受体结合域的突变可能直接影响病毒入侵细胞的能力 。 有的突变能导致 RBD保持“向上”状态不易坍塌 , 从而更容易进入细胞 。 德尔塔变异株的受体结合域上有 3 个突变 , 与细胞的亲和力更强 。 作为比较 , 阿尔法变异株的传播率比新冠病毒原始毒株高 50% , 而德尔塔比阿尔法变种又高出约 60% 。
不过 , 要做到传染性强 , 容易进入细胞还不够 , 病毒还得抢夺宿主细胞大量自我复制 , 以及具备逃避免疫系统打击的本领 。
人体的细胞工厂原本不是为了复制病毒服务的 , 每时每刻都在忙着自己的蛋白质合成 。 新冠病毒抵达细胞内部后首先合成一种病毒蛋白(Nsp1) , 它会切割不带病毒标记的人体细胞的核酸(携带着基因信息) , 令需要完整信息才能产生的人体蛋白无法合成 。
病毒把细胞工厂大肆占为己有 , 同时关闭细胞的预警系统 。 正常情况下 , 当细胞察觉到自己被感染 , 一部分特殊的基因会被激活 , 合成出能预警人体免疫系统的物质(如干扰素) , 释放出去召唤救兵 。 而又是Nsp1蛋白 , 它能阻塞细胞核的通道 , 不让那些核酸接触细胞工厂 , 也就无法合成预警蛋白 , 更遑论向外呼救 , 免疫系统便很难注意到被感染细胞发出的求救指令 。
文章图片
图3/6
狡猾的新冠病毒 , 不仅阻碍细胞正常蛋白质合成 , 还不让“报警”|维基百科
德尔塔病毒变异株不仅继承了所有这些诡计 , 成为“传染王”的它还另有一绝招 。
新冠病毒的刺突蛋白上下各亚基之间有个特殊的位点 , 称为“弗林(Furin)切割位点” , 因为它能被宿主细胞的弗林蛋白识别并切割 。 切割后 , 病毒颗粒的刺突蛋白会松开 , 暴露出里面和细胞膜性质相同的疏水性区域 , 将自己迅速与宿主细胞膜融为一体 。 普通冠状病毒也有这个位点 , 但一般只有一个精氨酸 。 新冠病毒的此处却是个由 5 个氨基酸(脯氨酸、精氨酸、精氨酸、丙氨酸、精氨酸)连成的“链子” , 更容易被识别 。
文章图片
图4/6
Furin蛋白酶的切割使刺突蛋白结构变得松散 , 因而能够被一种名为TMPRSS2的蛋白酶识别并被继续切割 , 从而暴露出其中的疏水氨基酸 , 进而得以快速进入细胞 。 图为TMPRSS2蛋白酶切割刺突蛋白 。 |Nature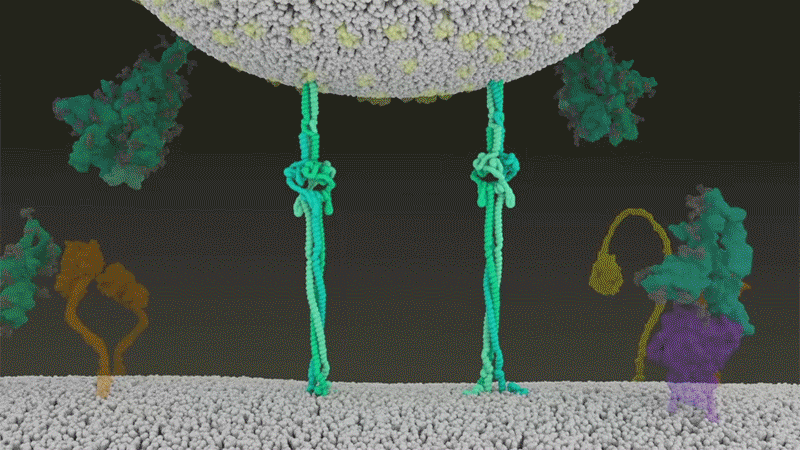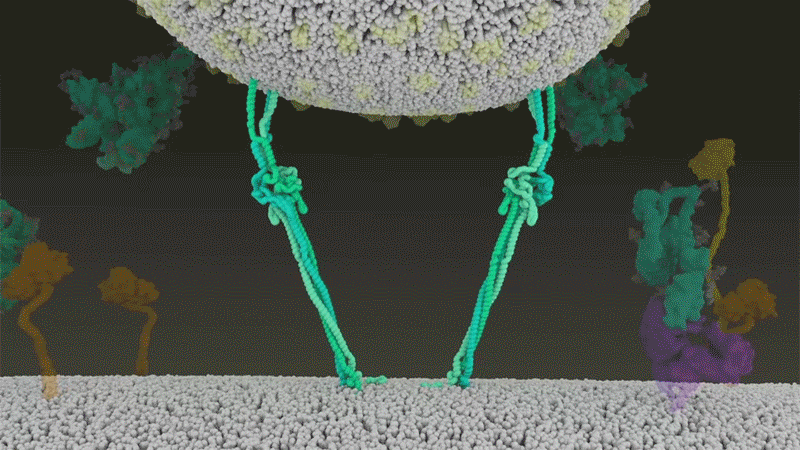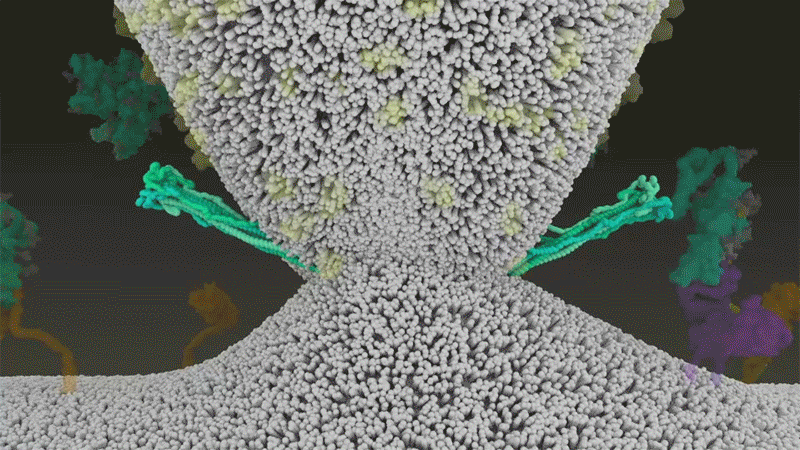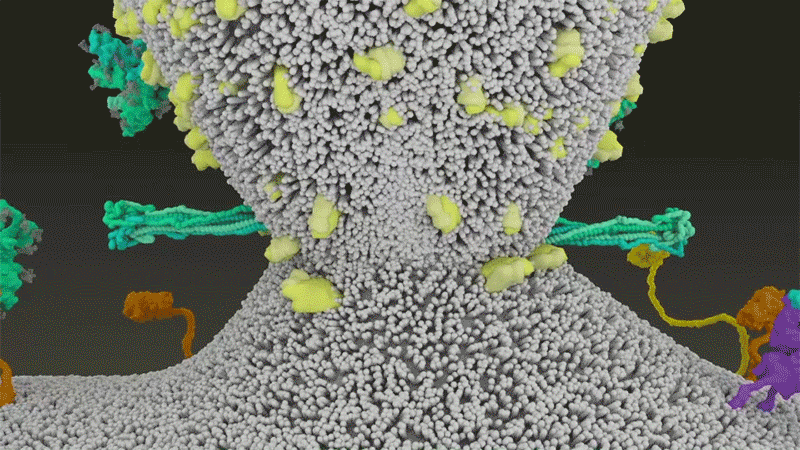
文章图片
图5/6
刺突蛋白附着在细胞膜上之后 , 通过折叠自身 , 拉扯病毒与细胞膜融合 。 |Nature
阿尔法和德尔塔变异株的弗林切割位点都发生了变化 。 前者将原来的脯氨酸替换成组氨酸;而德尔塔则替换成了精氨酸 。 这两个变化都会减少这条“链子”的酸性 。 氨基酸链的碱性越高 , 切割的效果越好 。 更多切割意味着更多刺突蛋白准备好进入人体细胞 。 SARS病毒只有不到 10% 的刺突蛋白做好了这种准备 , 阿尔法毒株超过了50% , 而德尔塔变异株这一比例高达75% 以上 , 成为其超强传染能力的重要原因 。
所幸 , 传染性更高并不意味着更致命 。 目前数据表明德尔塔变异株虽然更容易攻击50岁以下的较年轻的人群 , 使多地住院率上升 。 但并没有证据支持其更致命 。
完善疫苗接种有助于抵抗变异株
眼下主流的疫苗如灭活疫苗、核酸疫苗 , 基础免疫程序均为2剂次 。 各国正在对疫苗混搭、加打第三剂的方案展开研究 , 找出防范德尔塔变异株的有效策略 。
7月初 , 德国卫生部下属的常务疫苗委员会(STIKO)提议:已接种了第一针阿斯利康腺病毒载体疫苗的人群 , 第二针施打BioNTech/辉瑞或者莫德纳的核酸疫苗可获得 “极佳”的保护力 , 且间隔期可从12周缩短至最少4周 , “这对于防范德尔塔变种蔓延有着重大意义” 。
我国也在积极开展第三针加强针的效果研究 。
7月25日 , 科兴疫苗发布了一项研究结果(同行评审中) 。 该研究从2020年5月开始展开 , 共540名受试者参与 。 受试者被分为4组 , 先以14天和28天为间隔接种2剂科兴灭活疫苗 , 再以28天和180天接种第3剂疫苗 。
结果发现第三针可大幅提升人体免疫反应 , 中和抗体滴度较接种两针后提高数倍 。 但针对变异株是否有相同效果仍待研究 。
文章图片
图6/6
各国都在研究新的疫苗接种方案 。 |图虫创意
紧随其后 , 美国辉瑞/BioNTech也公布了核酸疫苗BNT162b2的加强针数据 , 对于德尔塔变异株 , 成年组接种第三针后 , 抗体滴度由241升至1321 , 提高超过4倍;老年组中 , 抗体滴度从124上升至1479 , 提高超过10倍 。
虽然接种第三针可使中和抗体滴度明显提高 , 但目前相关方案还没正式推广 。
当然 , 中和抗体数量并不是衡量疫苗好坏的唯一指标 , 人体免疫系统也并非对被感染的细胞束手无策 。
美国克利夫兰诊所的一项样本量超过5.2万的研究发现:曾感染过新冠病毒的人 , 5个月内抵抗再次感染的能力与注射疫苗相当 。 对于未感染过的人们来说 , 完成疫苗注射 , 不仅能获得可靠的防护 , 也有助于减少病毒的携带与传播等(包括无症状感染者) 。
钟南山院士曾提醒 , 我国需要83.3%的接种率才能达到群体免疫 , 特别呼吁重视疫苗接种 。
这是一场时间的竞赛 。 在疫情大肆复燃 , 或更棘手的变异出现之前 , 应尽可能争取让更多人接种疫苗 。 其他话不多说 , 保持距离、戴好口罩 。
(注:刚刚 , 一项新的研究指出 , 目前正在南美地区快速传播的拉姆达变异株 , 与原始版本相比 , 具有高度传染性 , 对疫苗的耐药性也更强 。 有分析认为 , 按照目前的传播趋势 , 拉姆达有可能取代德尔塔 , 成为下一阶段全球流行的优势毒株 。 )
(责编 高佩雯)
参考资料
1.https://www.medrxiv.org/content/10.1101/2021.06.17.21259103v1
2.https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(21)01358-1/fulltext
【新浪科技综合|德尔塔病毒为啥这么毒?轻松读懂变强秘密】3 。 Hoffmann M ,Kleine-Weber H ,P?hlmann S 。AMultibasic Cleavage Site in the Spike Protein of SARS-CoV-2 Is Essential forInfection of Human Lung Cells 。Mol Cell 。2020 May 21;78(4):779-784.e5 。doi:10.1016/j.molcel.2020.04.022 。Epub 2020 May 1 。PMID: 32362314; PMCID: PMC7194065 。
推荐阅读
- 产品|泰晶科技与紫光展锐联合实验室揭牌
- 空间|(科技)科普:詹姆斯·韦布空间望远镜——探索宇宙历史的“深空巨镜”
- 相关|科思科技:无人机地面控制站相关设备产品开始逐步发力
- 机身重量|黑科技眼控对焦23年后回归,升级! 江一白解读EOS R3
- 公司|科思科技:正在加速推进智能无线电基带处理芯片的研发
- 项目|常德市二中2021青少年科技创新大赛再获佳绩
- 视点·观察|科技巨头纷纷发力元宇宙:这是否是所有人的未来?
- 技术|聚光科技旗下临床质谱仪获批医疗器械注册证
- 视点·观察|科技股连年上涨势头难以持续:或已透支未来涨幅
- 视点·观察|科技行业都在谈论“元宇宙”,可是它还不存在







