文章图片
Amivantamab是首个针对EGFR和MET的双特异性抗体 。 2021年5月21日获得FDA批准 , 用于EGFR 20外显子插入突变NSCLC成人患者的一线治疗 。 而且 , 有研究者指出 , 该药物也在EGFR致敏突变患者中进行了研究 。
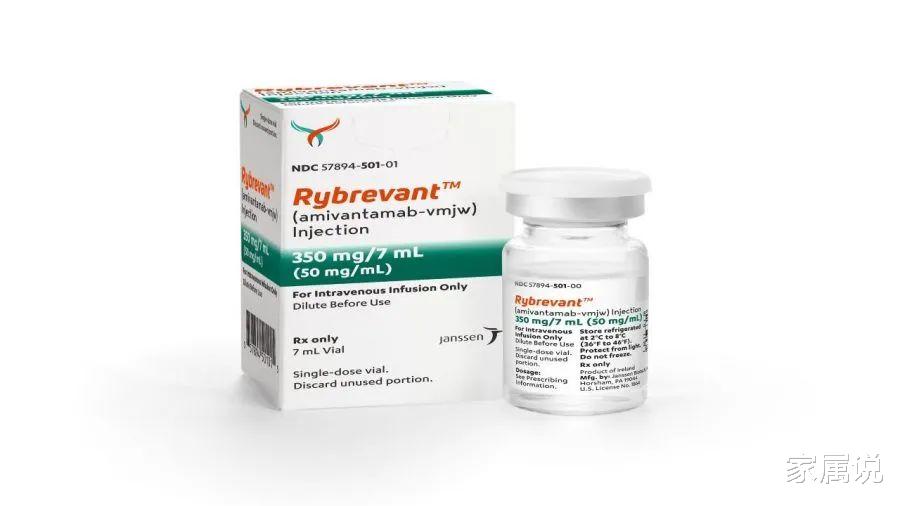
商品名:Rybrevant
通用名:amivantamab-vmjw
代号:JNJ-6372/JNJ-61186372
靶点:EGFR
美国首次获批:2021年5月
中国首次获批:尚未获批
获批适应症:铂类化疗后进展的EGFR外显子20插入突变(EGFR20ins)的转移性非小细胞肺癌(NSCLC)患者 。
推荐剂量:体重<80kg的患者接受1050 mg剂量;体重≥80 kg患者的剂量为1400 mg 。
规格:350mg / 7ml (50mg /mL)
储存条件:2-8℃冷藏保存
此外 , 第三代EGFR酪氨酸激酶抑制剂拉泽替尼也被发现在具有激活EGFR突变、T790M突变和中枢神经系统(CNS)疾病的NSCLC患者中具有强活性 。 由于这种药物的不良反应(AEs)发生率较低 , 如皮疹和腹泻 , 拉泽替尼被认为可以与其他抗EGFR抑制剂联合使用 。
商品名:Leclaza
通用名:Lazertinib(拉泽替尼)
代号:YH25448
靶点:EGFR
美国首次获批时间:尚未获批
中国首次获批时间:尚未获批
获批适应症:EGFR T790M突变阳性局部晚期或转移性非小细胞肺癌
规格:片剂 , 80 mg;一盒4板 , 一板21粒 , 共84粒 。
推荐剂量:240mg每天一次 , 空腹或随餐口服 , 应整片用水送服 , 不可碾碎、切割、咀嚼或溶解药片 。 如果漏服 , 发现时若离次日服药时间12小时以上 , 可以按量补服 , 下次服药仍按照原间隔时间 。
储存条件:室温下密闭保存 , 避免受潮 。
临床数据在CHRYSALIS-2试验中 , 入组患者接受240 mg拉泽替尼(每日1次) , 加上Amivantamab(第1周期的第1、2、8和15天接受1400mg 或1750 mg;第2周期第1天 , 第3周期1750mg或2100mg , 之后每3周给药一次) 。 患者还接受了500 mg/m^2的培美曲塞和卡铂 , 曲线下面积为5 , 4个周期后停药 。 Amivantamab的剂量取决于小于80公斤或80公斤及以上的体重 。
试验的主要终点是安全性;次要终点包括客观缓解率(ORR)、缓解持续时间(DOR)、临床获益率(CBR)、无进展生存期(PFS)和总生存期(OS) 。
入组患者的人群特征包括:EGFR突变NSCLC患者 , 这些患者之前接受了多达3种TKI治疗线 。 患者的中位年龄为61岁 。 大多数患者为女性和亚洲人 , 80%的患者ECOG评分为1 。 65%的患者有外显子19缺失 。 一半(50%)的患者在基线时有脑转移 。
先前治疗线的中位数为2 。 既往治疗包括第一代或第二代TKI(n=9;45%)、奥希替尼(n=14;70%)和铂类化疗(n=5;25%) 。
在2022年国际肺癌研究协会(IASLC)世界肺癌大会上提交的数据中 , 研究人员指出 , 无论脑转移如何 , 患者都能从治疗中获益 。
具体试验数据显示 , 中位随访时间为7.1个月 , 中位治疗周期为10 。 其中 , 卡铂和培美曲塞的中位治疗周期数分别为4和7.5 。
在所有患者中(n=20) , 客观缓解率(ORR)为50%(95% , 置信区间:27%~73%) , 临床获益率(CBR)为80%(95% , 置信区间:56%~94%) 。
在基线有脑转移的患者中(n=10) ,ORR为50%(95% , 置信区间:19%-81%) ,CBR为80%(95% , 置信区间:44%~98%) 。
其他发现证实了该方案的持久性 , 中位DOR、PFS和OS无法估计 。 值得注意的是 , 20例患者中有15例仍在接受治疗 , 包括所有10例有反应的患者 。
安全性该试验的研究者表明 , 个别不良反应大多是低级别的 , 与先前报道的Amivantamab和拉泽替尼数据一致 。
任何级别的EGFR特异性治疗紧急不良反应包括:皮疹(75%)、口腔炎(60%)、甲沟炎(50%)、痤疮样皮炎(35%)和腹泻(25%) 。 ≥3级的EGFR特异性治疗紧急不良反应包括:痤疮样皮炎(10%)、皮疹(5%)和腹泻(5%) 。
MET 特异性治疗紧急不良反应包括低白蛋白血症(任何级别:15%;≥3 级:5%) 。
其他报告的任何级别治疗不良反应包括:中性粒细胞减少症(85%)、输液相关反应(60%)、疲劳(50%)、恶心(40%)、血小板减少症(40%)、便秘(35% )、食欲下降(35%)、贫血(25%)、鼻出血(25%)、痔疮(25%)、白细胞减少症(25%)、消化不良(20%)、失眠(20%)、肺栓塞(20%)、呕吐(20%)、体重减轻(20%)、背痛(15%)、头晕(15%)、低镁血症(15%)、低钠血症(15%)、感觉异常(15%)和外周水肿(15%) 。
推荐阅读
- 空间站为什么不使用离心力来进行人造重力
- EGFR突变非小细胞肺癌脑转移患者治疗方案:吉非替尼联合化疗
- 普拉替尼治疗RET基因融合阳性的转移性非小细胞肺癌患者临床疗效
- 奥希替尼:罕见EGFR突变的非小细胞肺癌临床试验数据
- 菌群移植适合人群
- 女大学生查出艾滋, 医生: 校外男友导致的
- 金星上竟然发现城市! 遗迹足有万座之多是真的吗?
- 世界最重的花,有着“世界花王”之称,却被称食人花!







