
文章图片
1992年 , 日本免疫学家本庶佑教授发现了T细胞抑制受体PD-1 。 PD-1与肿瘤细胞表面配体PD-L1结合 , 导致T细胞的功能受到抑制 , 甚至诱导T细胞耗竭 。
CD8+ T细胞耗竭正是机体免疫系统不能有效清除慢性病毒感染及恶性肿瘤的关键原因 。 耗竭的CD8+ T细胞表面持续表达包括PD-1在内的免疫检查点分子 , 其增殖潜力、效应及杀伤功能等都较为低下 , 且易于凋亡 。 耗竭T细胞也一度被称为“僵尸”(Zombie)细胞 。
近十年来 , 基于PD-1 , 一种全新的免疫疗法——PD-1免疫检查点阻断疗法(Immune checkpoint blockade , ICB)正在改变癌症治疗的现状 。 PD-1 治疗的工作原理是通过单克隆抗体阻断PD-1介导的抑制性信号 , 从而在一定程度上逆转CD8+ T细胞耗竭 , 控制肿瘤进展 。
本庶佑教授的发现掀起了一场癌症疗法的革命 。 目前全球已有十余款PD-1/PD-L1 ICB疗法获批上市 , 用于治疗黑色素瘤、食管癌、非小细胞肺癌等近20种癌症 , 并取得良好的效果 。 这也让本庶佑教授与发现了另一种免疫检查点CTLA-4的James Allison教授共同收获了2018年诺贝尔生理学或医学奖 。
PD-1 免疫检查点阻断疗法的发展情况令人欣喜 , 但也仍然面临很大的挑战:首先是适用的癌症范围有限 , 一些恶性程度较高的癌种 , 如胰腺癌、脑胶质瘤、三阴性乳腺癌等 , 几乎不响应免疫检查点阻断疗法;即使在响应的肿瘤类型里 , 病人的总体响应率较低 , 只有约20%-30%;并且在开始响应的病人里 , 治疗后期大多会出现耐药抵抗 , 只有极少数病人可长期获益并临床治愈 。 因此 , 科学界需要更深入地理解PD-1免疫检查点阻断疗法的作用机制 , 从而提升其响应人群及临床治愈潜力 。
叶丽林团队及Rafi Ahmed、Di Yu等研究团队在2016年分别独立发现 , 慢性病毒感染中 , 一种位于淋巴组织内 , 耗竭程度较低的CD8+ T细胞亚群作为耗竭前体细胞(progenitor exhausted T cell Tpex) , 功能性响应PD-1免疫检查点阻断 。
Tpex的发现打破了将耗竭T细胞作为“僵尸”细胞的固有印象 , 并立即成为T细胞耗竭领域的研究热点 。 多项研究在实体瘤中也发现这种Tpex细胞对PD-1免疫检查点阻断应答的关键作用 。 后续更多的临床相关研究表明:此细胞亚群与PD-1免疫检查点阻断疗效相关 。
基于这些研究 , 领域内的普遍观点认为 , 位于肿瘤组织微环境内的Tpex细胞直接介导了PD-1免疫检查点阻断的抗肿瘤效应 , 但是此观点缺乏直接的实验性证据 。
近日 , 陆军军医大学全军免疫学研究所叶丽林团队与中山大学中山医学院唐忠辉团队及南京大学鼓楼医院孙倍成团队合作 , 在 Cell 期刊发表了题为:的研究论文 。
该研究首次发现在肿瘤引流淋巴结中存在肿瘤抗原特异性的记忆CD8+ T细胞 , 并证实了该群细胞在PD-1 ICB治疗中的关键作用 。
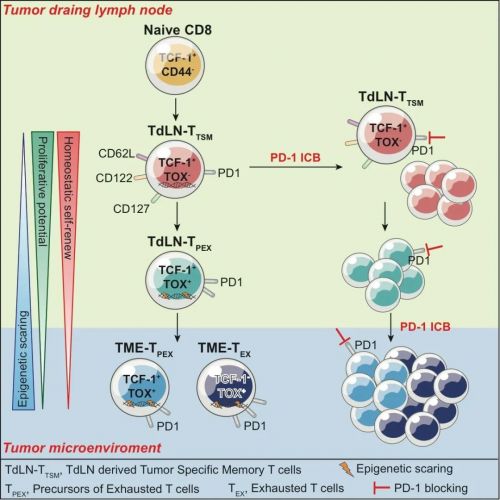
利用多种移植瘤及原位肿瘤诱导模型 , 研究团队首先检测了引流淋巴结内的肿瘤特异性CD8+ T细胞 , 发现其中一类高表达TCF-1、低表达PD-1、不表达耗竭特异性转录因子TOX的细胞群严格符合经典免疫记忆特征:不依赖于抗原长期存活;再次遇到抗原 , 迅速大幅扩增 , 并分化为功能性的效应细胞;提供长期的免疫保护 。
研究团队将其命名为肿瘤引流淋巴结抗原特异性记忆CD8+ T细胞 , 简称TdLN-TTSM 。
TdLN-TTSM细胞不同于此前发现的Tpex细胞进一步的分析发现 , TdLN-TTSM细胞转录特征更接近经典记忆细胞 , 而不是耗竭T细胞 。 与该群细胞的记忆特性相一致 , 向荷瘤小鼠分别回输来源于肿瘤和引流淋巴结的抗原特异性CD8+ T细胞 , TdLN-TTSM细胞呈现出显著优于Tpex的抑制肿瘤能力 。 在随后的体内和体外实验中 , TdLN-TTSM细胞在应对PD-1抗体处理时 , 比TdLN-Tpex细胞表现出更强的应答表现 。 并且 , 通过一系列肿瘤移植实验和淋巴结切除实验 , 发现PD-1/PD-L1 ICB处理后 , 肿瘤组织内扩增的抗原特异性CD8+ T细胞主要来源于TdLN-TTSM , 而不是肿瘤中已经浸润的、耗竭的Tpex细胞 。 无论在 PD-1/PD-L1 ICB治疗前或治疗中 , 去除此细胞亚群均导致PD-L1阻断抗体介导的免疫治疗失效;而回输TdLN-TTSM细胞则可以恢复此作用 , 这些实验结果进一步验证了TdLN-TTSM是真正响应PD1 ICB的细胞亚群 。
研究示意图总结这项研究 , 其创新性及对将来肿瘤免疫治疗研发的提示作用主要体现在以下几个方面:1、打破了在肿瘤负荷下 , 只存在耗竭T细胞 , 不存在肿瘤特异性记忆T细胞的传统概念;2、进一步完善了PD-1 ICB的时空作用机制:即PD-1 ICB先在引流淋巴结扩增、动员TdLN-TTSM细胞分化为耗竭前体细胞 , 再进入肿瘤微环境发挥作用 , 不同类型及状态的微环境可能决定这些PD-1 ICB动员的细胞发挥抗肿瘤作用的潜力 。 这一结论也提示 , PD-1 ICB与靶向肿瘤微环境的调节因子向结合 , 可能导致更好的协同抗肿瘤作用;3、对于需清扫淋巴结的肿瘤外科手术而言 , 清扫时可考虑从这些淋巴结中分选、扩增TTSM细胞 , 过继转输回术后病人 , 辅以免疫检查点治疗 , 可能会防止肿瘤术后复发或者转移;4、TdLN-TTSM细胞是相对于处于耗竭状态的肿瘤浸润淋巴细胞(TIL)更优的抗肿瘤过继T细胞疗法 。 因其记忆性特征及持久性抗肿瘤特点 , 以TTSM细胞为基础和靶标的过继T细胞疗法及PD-1+疗法可能会成为肿瘤免疫治疗基础研究与临床转化领域的下一个热点 。 论文链接:
推荐阅读
- 终于开始查了吗?核酸检测是否已经形成利益集团
- 狂犬病为何致死率99%?研究员切开死者大脑,揭秘狂犬病真相
- 牧之野:今冬疫情动向研判
- 为什么宇航员的免疫系统会受抑制,使其更易生病?
- 送样过程中毛发样本量过少导致毛发验毒假阴性
- 鲸鱼的尸体沉入大海之后,到底会发生什么事情呢?
- 分析稀有钻石 科学家:地球内或存在水世界
- 年近花甲,奔波不止!杜新枝线下维权画面尽显心酸,网友又吵翻了







