元素周期表外还有稳定的元素吗
文章图片

文章图片
门捷列夫原子量对已知元素进行排列 , 并注意到随着原子量的增加 , 化学性质会周期性地重复出现 。 我们现在知道 , 化学性质取决于价电子的数量 。 每向原子核添加一个质子 , 价电子就会增加一个 , 直到电子层被填满 。 尽管他不了解质子 , 但门捷列夫确实注意到了他的元素周期表中的空白 。 他正确地将这些空白解释为尚未发现的四种元素 , 甚至能够预测它们的许多属性 。
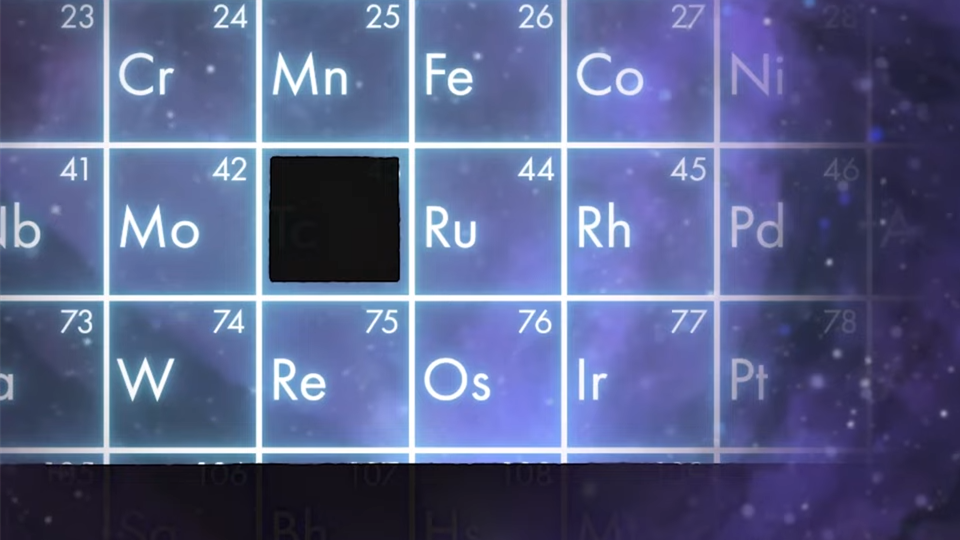
随着时间的推移 , 这些元素中的三种被发现了:钪、镓和锗 。 但是仍然缺少一种元素 , 就在钼和钌之间 , 我们发现它必具有43个质子的原子核 。 七十年来 , 化学家一直在寻找43号元素 , 但在自然界中无处可寻 。 但它最终被发现了 , 但不是在自然界中 。
1937年 , 意大利物理学家Emilio Segrè得到了一些钼箔 , 这些钼箔曾是欧内斯特·劳伦斯新发明的回旋加速器的一部分 。 箔在加速器中呈现放射性 , Segrè 和他的Carlo Perrier能够证明 , 一些钼获得了质子转化为43号元素 。 他们以希腊语“艺术”一词命名新元素为Technetium , 中文名为锝 。 它是一种银灰色金属 , 化学性质介于锰和钌之间 , 元素周期表中位于锰之下和钌之上 。
【元素周期表外还有稳定的元素吗】那么 , 当所有其他元素都可以在自然界中找到时 , 为什么我们必须人工生产
元素可能不稳定的想法的一个更常见的术语是放射性 , 我们倾向于将其与铀和钚等非常重的元素联系起来 。 但实际上元素周期表上的任何元素都可能不稳定 。 更准确地说 , 元素周期表上的每个元素都有不稳定的同位素 。 “同位素”是指具有不同中子数量的同一元素的不同版本 。
例如 , 一个碳原子的原子核中有6个质子 。 碳-12有6个中子 , 它非常稳定 。 而碳-14有8个中子 , 它非常不稳定 , 它有一个多余的中子在放出电子和中微子后转变成质子 , 从而将其转变为氮 。 每种元素都有不稳定的同位素 , 有些元素只有不稳定的同位素 , 较大的原子序数往往会产生较少的稳定同位素和较短的半衰期 。 具有超过118个质子的元素衰变得如此之快 , 以至于我们从未在实验室中检测 。
事实上 , 稳定性取决于原子核中质子和中子之间的平衡 。 你可能会认为 , 经过一个半世纪的核物理学思考 , 我们已经弄清楚了所有这些规则 。 但实际上原子核的动力学是如此复杂 , 以至于需要复杂的计算机建模才能理解 , 然而许多谜团仍然存在 。
原子核是极端力量处于微妙平衡的地方 。 一方面 , 我们有电磁力试图将所有带正电的质子分开 , 并且由于质子的距离很近 , 所以这种排斥力很大 。 另一方面 , 我们有更强大的核力将核子聚集在一起 , 它涉及在核子之间发送虚夸克包——介子 。 但重要的是要知道强力是短程效应 , 如果原子核变得太大 , 强力就无法将其保持在一起 , 各种类型的核衰变就不可避免 。
强力虽然很强大 , 但在真正起作用的短短距离内 , 力量却没有太大的变化 。 然而 , 两个电荷越接近 , 电磁力就会越强 。 这意味着如果质子靠得太近 , 电磁力可以压倒强力 , 这是破坏原子核稳定性的另一种方式 。 这就是中子起作用的原因 , 它们有助于隔开质子 , 从而使强力强于电磁力 。
对于较小的原子核(原子序数最多为 20) , 质子和中子的均匀分布通常是最稳定的 。 但对于较重的元素 , 需要越来越多的中子来提供缓冲 , 达到1.5或更高的中子与质子比 。 但这只是稳定性理论的一部分 , 它没有解释为什么单个中子的差异可能意味着稳定性的巨大差异 , 它也没有解释为什么锝没有稳定同位素 。
要理解这一点 , 我们必须超越将原子核表示为一团混乱的质子和中子的想法 。 我们必须将这些核子视为具有能级 , 就像电子一样 。 高中化学课上讲过的:如果一个电子壳层有八个电子 , 它就是稳定的 。 类似的 , 有一些可以完成核壳的幻数 , 中子是2、8、20、28、50、82、126 , 质子是 2、8、20、28、50、82、114 。 原子核越接近这些数字 , 它就越稳定 。
推荐阅读
- 美国研究显示,大脑和神经系统中,缺乏一些必需的微量元素不仅会影响大脑的工作
- 核聚变的终点是铁,那么铁之后的元素是怎么诞生的?
- 鹈鹕未来争霸不只有锡安·威廉森,另外三项关键元素已到位!
- 神秘的115号镆元素,竟是UFO的动力驱动物质?它存在于什么星球?
- 115号镆元素被认为是外星飞船驱动装置的重要组成部分,可能吗?
- 上海市|上海最隐蔽的“老街”,人气不输南京路,复古元素独具海派风情
- 古镇|大理真的才是充满了人文元素,酒吧各式各样,青年挤满了街头
- 蜡梅|红河有水(二)康养“元素”







