
文章图片
文章图片
在全球慢性乙肝新药研究领域 , 除了我们所见到的核心蛋白抑制剂、乙肝表面抗原抑制剂、RNA去稳定剂、RNA干扰、反义寡核苷酸、治疗性疫苗、FXR受体激动剂、TLR激动剂等新机理候选药物之外 , 我们也能够看到 , 全球仍有科学家正在开发新型聚合酶抑制剂 。
乙肝新型聚合酶抑制剂 , 开发数量正减少 , 新机制依然是探索阶段
一、开发数量正在减少
【纳米|乙肝新型聚合酶抑制剂,开发数量正减少,新机制依然是探索阶段】聚合酶抑制剂(NRTIs) , 即我们所说的核苷(酸)类似物(NAs) , 如当前的恩替卡韦、富马酸替诺福韦酯(TDF)和富马酸替诺福韦艾拉酚胺(TAF) 。 从NA长期开发经验来看 , NRTI的单一疗法可能会导致耐药病毒出现 , 因此 , 这一新药研发方向 , 未来将会是组合NA之一的方式 , 在对耐药病毒可能产生协同抑制作用 。
比如 , 已终止研发的乙肝新药CMX157(Chimerix公司研发 , 2期) , 它是一种替诺福韦前药 , 新型聚合酶抑制剂 , 即Tenofovir exalidex 。 它的主要研发意义是 , 因其新的脂质偶联制剂显示出特定肝脏营养 , 可以减少与骨骼和肾脏相关的不良反应 。 已经公布的其中期数据表明 , 100毫克剂量的CMX157可以导致平均HBVDNA为3.63 log10 IU/mL 。
还有一款新型聚合酶抑制剂是贝西福韦(Besifovir dipivoxil maleate) , 在其已经公布的48周治疗后试验数据 , 它和替诺福韦相比 , 其抗病毒作用没有显著差异 。 之所以 , 全球仍在继续开发新型聚合酶抑制剂新药 , 主要是提供患者更多替换选择 。
二、未来相同靶点的开发方向
从全球慢性乙肝新药研发看 , 新型聚合酶抑制剂的开发数量已经明显减少 , NRTIs未来方向应主要以减少暴露于骨骼和肾脏毒性和增强抗病毒作用为主 。 值得注意的是 , NRTIs不仅仅在HBV领域 , 也被广泛用于HIV领域 。 干扰素(IFN) , 是抑制作用机理和NRTIs完全不同的现有方法 , 在提高HBV抗病毒作用方向 , 在未来NRTIs+IFN的组合方式 , 或将有助于提高其有效性 。
三、新机制探索
乙肝病毒是导致全球大部分慢性肝病和HCC主要原因 , 这也是一个极度尚未满足的医疗需求 , 现有方法想要从肝细胞中根除乙肝病毒方向收效甚微 , 往往需要长期甚至终身给药(NAs) , 因此 , 基于以上原因 , 科学家正在研究针对乙肝病毒生命周期各个步骤的新药物 。
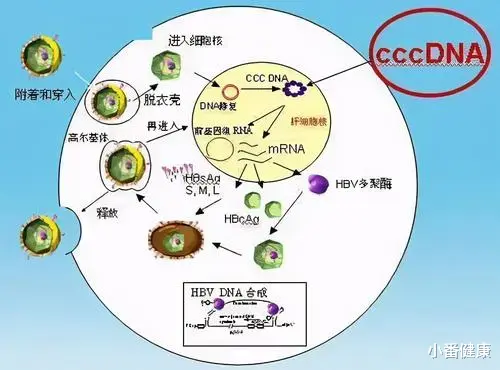
现有已经开发的药物 , 主要是核苷类似物 , 它们可以抑制HBV复制 , 但还无法从肝细胞中根除HBV 。 最主要原因是 , HBV共价闭合环状DNA(cccDNA)的持续存在 , 还有慢性乙肝患者的免疫系统无法建立足够的免疫反应 。 因为这些原因 , 慢乙肝患者才需要延长甚至终身使用NA , 并且这些现有方法都不能消除患HCC风险 。 因此 , 科学家正在深入探索HBV生命周期 , 针对特定靶点的在研新药正在开发或处在临床研究阶段 。
小番健康结语:不难看出 , 目前一些新机制药物的组合或NA组合新机制药物 , 已在促使乙肝表面抗原水平下降方面带来一些进展 。 但从药物机理方向 , NAs+cccDNA抑制剂可能更加接近当前目标 。 因为如正在开发的病毒进入抑制剂Myrcludex B , 它也是一种新型直接抗病毒药物(DAA) , 组合效力即便比单独应用更强 , 对已经感染细胞也不会受到影响 , 因此 , 这种组合也不容易实现功能性治愈HBV 。
许多人问 , CRISPR/Cas9是否可以实现更高目标?目前这种技术有许多障碍 , 主要集中在递送问题、宿主基因组脱靶效应等 。 表观遗传修饰剂 , 也是一类比较有潜力的技术 , 因为它能够刺激肝细胞周转 , 防止cccDNA池更新 , 从而帮助减少HBV病毒库 , 但这种技术目前存在特异性问题 , 这类化合物可能会改变染色质调节 。
推荐阅读
- 新的文件格式帮助研究人员缩短DNA分析时间
- 2022 年12 个令人兴奋的里程碑事件
- 研究表明,地球上的第一个生命依赖于一种致命的有毒气体
- 纳米晶体技术已成功应用于难溶性药物,以克服药物溶解度差的缺点
- 科学家成功地配制了,各种具有溶解和吸收行为优势的纳米晶体制剂
- 河马50厘米长的犬齿不外露,剑齿虎的牙齿复原有没有可能搞错了呢?
- 水不溶性药物由于溶解度低需要大量有机增溶剂,容易导致不良反应
- 斯坦福科学家用年轻人血液让老年人逆生长27%,或成延寿爆款
- 科学家证明了,纳米悬浮液中的真皮姜黄素纳米晶体,具有更好的皮肤渗透性
- 华林科纳氮化镓的大面积光电化学蚀刻的实验报告







