本文图片
近年来 , 一些研究发现人类胎盘独特的、侵袭子宫壁的方式 , 与癌症的严重程度有关 。 一项发表于《自然》的新研究揭示 , 胎盘中的细胞具有大量的基因突变 , 十分类似于癌细胞 。 而胎盘是一个由多个“癌细胞”模块 , 拼接起来的器官 。 而在长达9个月的时间内 , 每一个胎儿时刻都在与它们为伴 。
每当一个胎儿降生 , 其母亲体内就会有一个胎盘脱落 , 并离开子宫 。 胎盘在孕妇体内存在的时间仅9个多月 , 但它在繁育后代的过程中至关重要 。 它的一端连接着母亲的子宫壁 , 另一端连接着胎儿的血液系统 。 胎盘能将两者的血液系统分开 , 避免了母亲体内的免疫细胞进入胎儿体内 , 导致其死亡 。 但与此同时 , 它又能将母亲体内的营养物质、氧气和抗体等传递给胎儿 , 帮助其正常地生长和发育 。
特殊的起源
虽然胎盘极其重要 , 但相比于人体的其他器官 , 我们对它的关注较少 。 近年来 , 关于胎盘如何出现和其连接子宫壁的独特方式 , 引起了一些科学家的兴趣 。 据相关研究 , 胎盘出现的时间可以追溯到2亿~1.5亿年前 , 当时一些动物的生育方式开始由卵生转变为胎生 。 Edward B. Chuong是科罗拉多大学的基因组学家 , 他在分析人胎盘细胞的基因时 , 发现其中一些明显不是人类的基因 , 而是来自逆转录病毒 。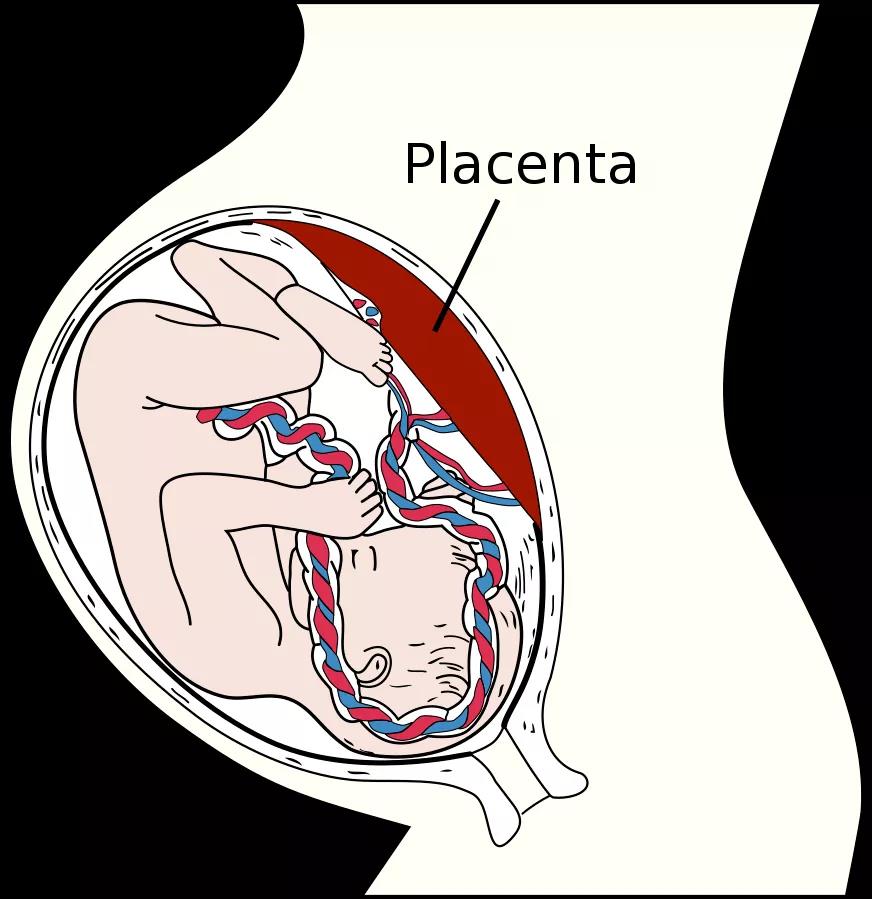
本文图片
【癌细胞|这个器官由“癌细胞”拼接成,我们却靠它生活了9个月】图片来源:维基百科
类似于HIV , 这些逆转录病毒通过逆转录整合到人体的基因组中 。 在2018年一篇发表于PLoS子刊的文章中 , Chuong发现一个来自于逆转录病毒的基因 , 能通过表达合胞素(Syncytin-1) , 促进胎盘中合胞体滋养层(syncytiotrophoblast)的合成 。 这是胎盘最外层的细胞 , 它与子宫壁相连 , 分离母体和胎儿的血液系统 , 同时保证两者之间的物质交换 。
在胎盘中 , 逆转录病毒的基因还能控制由胎盘分泌的促肾上腺皮质激素释放激素(corticotropin-releasing hormone)的水平 , 进而控制胎儿的生长状态和出生时间 。 当这种激素的水平异常时 , 可能会导致早产、新生儿体重过轻等现象 。
在Chuong看来 , 这是一个外来的病毒基因被人体驯化的结果 。 这些逆转录病毒的基因整合到哺乳动物的基因组中 , 和其他基因一起协同发挥功能 , 进而彻底改变哺乳动物生育后代的方式 。 这种方式带来了更多的益处 , 如增加后代的存活几率 。 但对人类来说 , 这种生殖方式在带来诸多优势的同时 , 也展现出意料之外的负面影响 。
癌症变严重的原因
一些科学家注意到 , 在不同的哺乳动物中 , 黑色素瘤的扩散情况并不相同 。 相比于牛和马等 , 人类抵抗肿瘤细胞扩散的能力更弱 。 耶鲁大学的科学家在2019年发表于《自然·生态与演化》的研究中揭示了部分原因 。 哺乳动物胎盘中的合胞体滋养层 , 能实现母亲和胎儿之间的物质交换 。 但这些细胞入侵雌性子宫内膜的方式 , 十分类似于癌细胞进入正常组织中的细胞间质的过程 。 另一项研究发现 , 在哺乳动物中 , 当滋养层细胞的入侵性越强时 , 其体内的多种癌症(包括皮肤癌、乳腺癌和软组织瘤)或许更容易扩散 。
耶鲁大学的科学家表示 , 胎盘与子宫壁的连接方式 , 是各种哺乳动物在后期独立演化出的结果 。 而人类的癌症更容易转移 , 可能是后期演化中妥协的结果——细胞的侵袭性更强时 , 也意味着胎儿能得到更多的营养 , 从而更好地发育 。 但这些滋养层细胞为什么具有更强的侵袭性?研究人员并没有给出解释 。
近期 , 在一篇发表于《自然》的论文中 , 科学家或找到了一个能解释这一现象的原因:实际上 , 在胎盘中的滋养层细胞与癌细胞十分相似 , 有着大量基因突变 。 这也意味着在母亲怀孕期间 , 胎儿或时刻与这些危险的细胞相伴 。
由“癌细胞”组成的胎盘
在研究中 , 英国维康桑格研究所和剑桥大学的科学家从37个胎盘中分离了86个胎盘细胞组织样本 。 通过对这些样本的全基因组测序 , 他们发现其中近一半的细胞存在基因突变 , 包含大量单碱基置换 。 其中 , SBS18在胎盘细胞中最为常见 , 这种单碱基置换导致了细胞中近43%的突变 。
除了单碱基置换 , 这些胎盘细胞样本中还存在其他类型的基因突变 , 例如小片段碱基的插入、删除 , 以及基因拷贝数的改变 。 近一半的胎盘细胞样本中至少存在一处基因拷贝数改变;其中一个样本还出现了染色体异常 , 拥有3条10号染色体 。 但在脐带的间充质细胞(成纤维细胞、肌肉细胞等的混合物)和胎儿细胞中 , 就不存在这样严重的基因突变情况 。
研究人员猜测 , 由于胎盘是一个暂时、多余的器官 , 因此在大多数组织中 , 用来保护染色体和基因组的机制 , 在胎盘滋养层中并不会发挥作用 。 例如 , 上段中有3条10号染色体的现象 , 在胎儿体内并没有出现 , 这是由于受精卵中的三染色体救援(Trisomic rescue)过程清除了一条10号染色体 。
研究团队在对胎盘不同区域的滋养层细胞进行测序时 , 还发现了一个有趣的现象:在单个滋养层细胞群内部 , 细胞中基因的相似性很高;但不同滋养层细胞群之间 , 基因突变的差异却很明显 。 这提示单个滋养层细胞群或由一个祖细胞演化而来 。 祖细胞在多次复制时 , 基因突变会逐渐累积 。 随后 , 它和其他胎盘细胞群拼接成胎盘 , 形成一个由具有不同“癌变”特征的细胞群拼接起来的“马赛克” 。
该文章的通讯作者、剑桥大学的Steve Charnock-Jones教授说:“这项研究首次证实 , 胎盘的组织结构与其他人体器官不同 。 事实上 , 它就像不同的肿瘤细胞拼接起来的 。 与人体其他健康的组织相比 , 它的基因突变率和一些突变模式高得有点离谱 。 ”
那么这些突变的胎盘细胞对胎儿有害吗?此前的研究表明 , 胎盘中的染色体畸变会导致1%~2%的生殖异常 。 在胎盘中 , 细胞的基因突变会导致胎盘功能不全 , 且还会诱发多种产科并发症 , 例如早产、胎儿死亡和胎儿宫内生长受限等 。
在这项新研究中 , 科学家发现 , 一些新生儿易患的癌症(例如成神经细胞瘤和横纹肌肉瘤)中也存在大量SBS18类型的单碱基置换 。 当胎儿还在子宫发育时 , 这些癌症的种子就已经形成 , 这或与胎盘细胞具有一定的相关性 。 研究人员表示 , 这一研究建立起了胎盘基因异常和新生儿状态之间的联系 。 使用更大样本进行后续研究 , 或将有助于揭示在怀孕期间 , 母亲或胎儿出现并发症或其他疾病的原因 。
作者:石云雷
编辑:吴金娇
责任编辑:许琦敏
来源:环球科学
图片:pixabay
声明:转载此文是出于传递更多信息之目的 。 若有来源标注错误或侵犯了您的合法权益 , 请作者持权属证明与本网联系 , 我们将及时更正、删除 , 谢谢 。
推荐阅读
- 大脑|新冠病毒会在患者器官内滞留数月
- RNA|这个环状RNA可以抑制动脉粥样硬化
- 来自|来自地球,向往火星:年度人物马斯克的“移民外星梦”,竟然来自这个“秘密”
- Top10|年度最佳发明竟然有Xbox和意面 这个榜单靠谱吗?
- 文件|微信上线了这个新功能!
- 苹果|苹果配件必须买原装 这个错误言论为何误导了很多人?
- 吸附|擦窗机器人怎么选?这个实验告诉你答案
- _blank|【找教练】正手连续拉球时,这个动作非常重要!-乒乓国球汇
- 王林辉|这个全国协作组在沪成立,将推进肾癌领域国产手术机器人问世
- 云米|小米生态链再出爆品,云米踢脚线电暖器,让这个冬天不再冷







