
文章图片
文章图片
文章图片
本文由brainnews脑科学世界团队原创编译 , 转载请联系授权 。
近年来 , 随着光遗传学技术的发展 , 其在神经科学领域的应用越来越广泛 。 得益于其对靶向目标的专一性 , 操纵时间上的快速性和精确性 , 相比于化学遗传学等其他的方法 , 光遗传学成为操纵突触前神经递质释放的最佳方法 。 然而 , 由于光遗传学工具多种多样 , 在使用前需要了解它们的特性以及它们靶向目标的特性 。
Ofer Y教授团队据此总结了光遗传学工具在突触前的种类和应用策略 , 并将其成果“Optogenetics at the presynapse”于2022年7月发表于Nature Neuroscience杂志 。
光遗传学工具的生物物理特性
目前使用的光遗传学工具主要分为三类:视紫红质、蓝光受体(BLRs)以及光敏剂 。 视紫红质包含了一个7个螺旋的膜蛋白(视蛋白) , 视黄醛发色团镶嵌其中并与视蛋白共价结合 , 光刺激后视黄醛会出现构象改变 , 从而改变其状态 。
视紫红质分为I类(微生物型)视紫红质和II类(动物型)视紫红质 , 其中I类又分为光敏通道蛋白(ChRs , 被动转运的离子通道) , 光驱动的离子泵(主动转运)以及酶视紫红质 , II类则是特异性被光激活的G蛋白偶联受体(GPCRs) , 也可以分为视觉型视紫红质(视感蛋白、视锥蛋白)和非视觉型视紫红质 。
BLRs使用黄素作为发色团 , 有黄素单核苷酸(FMN) , 黄素腺嘌呤二核苷酸(FAD)以及核黄素 , BLRs可以控制多个效应蛋白 , 在光消失之后 , 也会存在残留的暗活性 , 无法做到精准的时间控制 , 主要应用在植物和细菌中 。 BLRs可以分为光-氧-电压域(LOV)、蓝光传感器利用FAD域(BLUF)以及隐花色素(CRYs) 。
遗传编码的光敏剂都源于拟南芥向光素2的绿色荧光蛋白或者LOV2区域 , 照射后 , 会产生活性氧 , 单线态氧会氧化多种氨基酸侧链 , 从而在20-150nm光下使相应的蛋白质失活(原位发色团辅助光失活(CALI)) 。
图1.光遗传致动器概述
靶向光遗传学驱动器于轴突和突触前
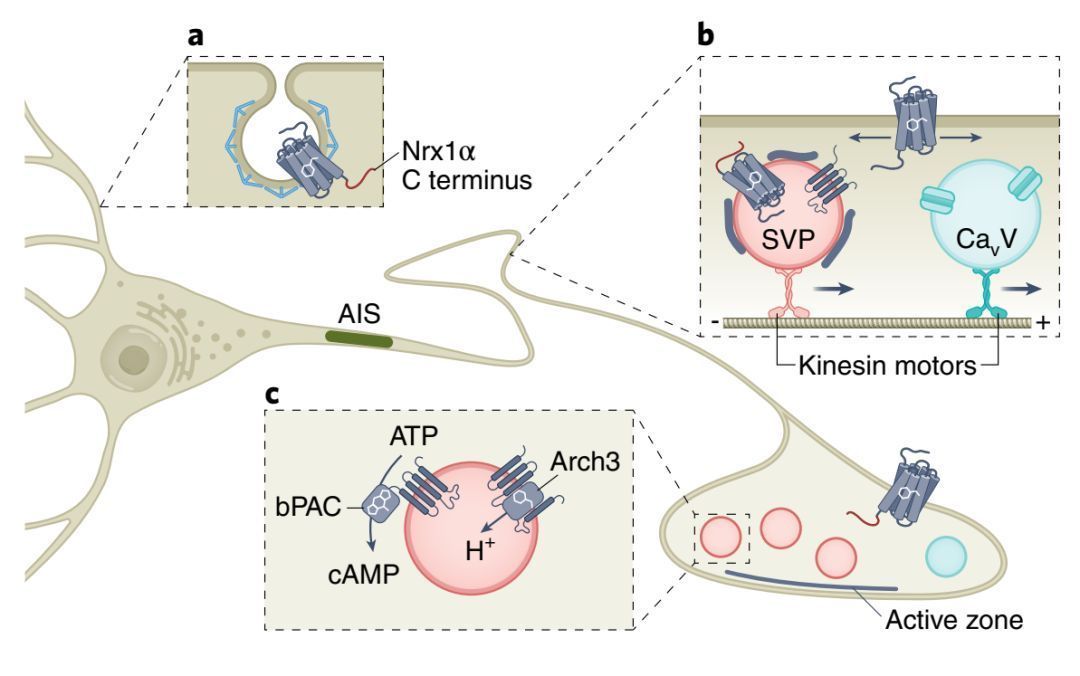
【Nat Neurosci系统总结:突触前的光遗传学】由于大部分的光遗传学工具都源自于种系发生很远的物种 , 在哺乳动物细胞中缺乏定位信号 , 因此经常会导致光遗传学工具无效的膜定位 , 细胞内聚集以及高浓度时的细胞毒性 。
目前没有通用信号序列用于靶向光遗传学工具于轴突和突触前 , 但是有两种机制可以促进轴突定位:一是通过胞体树突部位优先胞吞的单向膜插入 , 二是通过特异性囊泡进行的轴突导向的转运 , 例如将光遗传学工具融合到突触素中 , 可以促进它在突触前细胞质或者突触囊泡腔的表达升高(图2) 。
图2.光遗传致动器的轴突运输和突触前靶定
光遗传学工具在突触前的应用
光敏通道辅助的环路映射(CRACM)主要促进突触前释放 , 其策略是将阳离子型ChR(CCR)表达于突触前 , 之后光照射目标区域 , 导致轴突膜去极化 , 从而产生动作电位(AP) , 之后AP引起钙离子内流 , 从而导致突触前释放 , 同时检测突触后的电流 , 从而观测两者之间的功能连接 。
但CRACM也存在问题 , 即AP产生之后 , 向下传导的同时 , 也会逆向传导 , 导致侧枝突触前释放 , 使得体内CRACM实验结果变得复杂 。 在体外脑切片中 , 可以通过同时抑制突触前钠离子和钾离子通道 , 使光照后目标区域有钠离子内流的同时不产生AP , 并激发钙离子内流从而释放神经递质 。
在生物中可以通过局部注射利多卡因或者特异性阻断突触后受体来达到上述效果 。 相比于电刺激 , 光刺激突触前末端会产生更大的突触后反应 , 而且不同的实验流程、不同的通路以及不同的细胞类型 , 光遗传学刺激的效果都可能不同(图3) 。
图3.通过CCR刺激导致的光诱导的神经递质释放的概念和缺陷
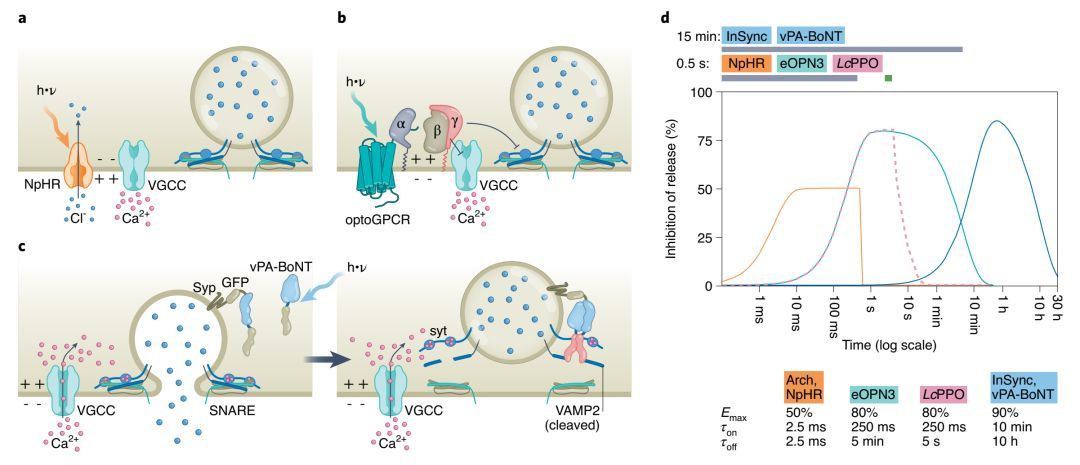
光遗传学抑制神经递质释放则有3种策略:
其一 , 通过外向的质子泵(ArchT Arch3 Jaws)或者内向的氯离子泵(NpHR)使轴突膜超极化从而抑制AP的传播 , 降低突触前钙离子内流 。 递质传递的降低在光照瞬间发生 , 并在照明终止后的几秒钟内消失 。 这种方法适合快速抑制的实验 , 因为一旦时间加长(几分钟)就会产生其他非预期效应 。
推荐阅读
- 高手是怎样做的?生物学思维:事物间存在关联、动态和特殊情况
- 动物刺客——小心地球上最致命的生物
- 科学家发现,蜜蜂飞行违背自然规律,理论上不可能飞起来
- ?被自己“杀”死的动物,躲过了天敌,却死在自己手里
- 损失4个亿!78亿只蜜蜂都去哪儿了?
- 一个特殊病例死后,大脑活动竟然还持续了10分钟的,是回光返照?
- 韩国78亿只蜜蜂离奇消失,预计损失高达4亿,蜜蜂为何成群消失?
- 草甘膦引发粮食危机?蜜蜂正加速走向灭绝,人类把自己赶尽杀绝?
- 大黄蜂战斗实力爆表,亚洲蜜蜂却不怕它,它有何绝招能抗击天敌?







