
文章图片

文章图片

文章图片
文章图片
自闭症是目前还无法治愈的一种先天性精神障碍疾病 。
尽管神经病理学研究尚未发现自闭症患者的一致的缺陷 , 但科学家们早已怀疑自闭症与胎儿早期大脑发育的整体失调有关 。
上个月 , 罗格斯大学的研究团队在著名科研期刊《Stem Cell Reports(干细胞报告)》发布了一篇题为《Autism NPCs from both idiopathic and CNV 16p11.2 deletion patients exhibit dysregulation of proliferation and mitogenic responses》的研究论文 。
他们检查了自闭症患者的大脑干细胞——神经前体细胞(NPC) , 发现NPC负责产生三种主要类型的脑细胞:神经元 , 少突胶质细胞和星形胶质细胞——要么过度生产 , 要么生产不足 。
01
在过去 , 许多研究都是以小鼠为研究模型 。 但涉及大脑神经发育方面的 , 这种形式的研究就比较局限 , 因为动物通常不会表现出人类患者所表现出的症状 。
为了模拟患者大脑早期发育过程 , 寻找自闭症的形成原因 , 罗格斯大学的研究团队把目光投向了人类自身拥有的干细胞 。
他们通过诱导多能干细胞(iPSCs)技术生成人类大脑干细胞 , 这些大脑干细胞可以在体外精准表现出自闭症患者大脑早期发育阶段的所经历的变化 , 为寻找自闭症的有效调节方法带来了希望 。
该研究共纳入了十个研究对象 , 包括3名特发性自闭症患者以及3个患者的健康的兄弟姐妹作为对照 , 2名患有16pDel(16p11.2缺失综合征)自闭症患者以及2名相同性别的健康对照 。 其中编号为ASD-1077患者以及两名16pDel患者均患有大头畸形 。
研究人员将这些研究对象的干细胞诱导分化为一种大脑干细胞——神经前体细胞(NPC) 。 正常情况下 , 神经前体细胞通常会在人类胎儿40周妊娠期的第8周到第24周内增殖分化形成功能脑细胞 。
实验结果发现 , 与健康的对照组相比 , 无论是特发性自闭症队列还是16pDel自闭症队列都表现出神经前体细胞增殖失调 。
△ 患者的NPC表现出增殖失调
其中ASD-1012患者和ASD-1072患者的NPC产生了太少脑细胞 , 尽管他们的外表看上去是正常的 。
而大头颅的ASD-1077患者和两个16pDel患者的NPC则产生了太多的脑细胞 , 而这就是大头颅自闭症患者大脑过度生长的原因 。
“我们从所有(疾病)样本中研究的NPC显示出异常增殖 , 无论是'太少'还是'太多' , 这表明对脑干细胞增殖的控制不佳是自闭症因果关系的重要基础 , ”神经科学和细胞生物学教授Emanuel DiCicco-Bloom以及罗格斯大学罗伯特伍德约翰逊医学院的儿科和该论文的作者说 。
△ 中国科学院院长白春礼:中国科学院改革开放四十年
02干细胞可以改善和修复神经系统的结构和功能
干细胞是人类的原始细胞 , 也被认为是“多能细胞” , 可以分化为各种类型的细胞、组织 , 不仅能够作为自闭症的体外模型 , 在再生医学、药物开发和精准医疗等多个方面也同样拥有着广泛的应用前景 。
所谓解铃还须系铃人 , 目前干细胞移植技术已经在调节自闭症这类神经系统疾病中获得了初步成功 , 证实干细胞可以在一定程度上改善和修复神经系统的结构和功能 。
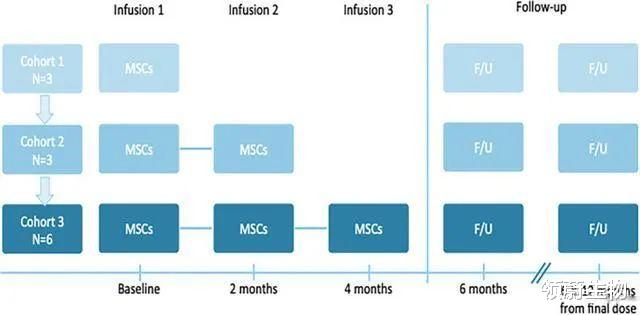
2020年杜克大学研究团队发表在《Stem Cells Translational Medicine(干细胞转化医学)》上的一项研究显示:脐带间充质干细胞为自闭症儿童带来了安全的疗效 , 而且在此次研究中 , 单次剂量和重复剂量的输注都起到了调节效果
研究者招募了12名患有自闭症谱系障碍的儿童 , 年龄范围为4-9岁 , 分为三组 , 第一组三名患者接受单次输注 , 第二组三名患者接受两次输注 , 第三组六名患者接受三次输注 , 每次输注的剂量相等 , 每次输注期间间隔两个月 。
△ 研究实验设计
其中 , 第二组一位患儿在第二次输注时出现了轻度低血压以及超敏反应 , 之后给予对症处理后不良反应消失 , 随后继续调节 , 未出现明显不适 。 第三组一位患儿出现了中度低血压 , 经过处理后没有出现不适 , 也完成了调节 。
推荐阅读
- 干细胞疗法有望治愈自闭症
- 克隆体有肚脐眼吗?为何现在很少提克隆,克隆羊多莉结局很惨吗?
- 发现一颗年轻恒星,很类似早期太阳的模样,看起来很酷
- 无法治愈的肺动脉高压迎来救赎?利用妹妹的脐带间质干细胞,治疗姐姐的肺动脉高压
- 天文学家发现,参宿四在经历了2019年的爆发后正在反弹
- 天舟三号受控坠入地球!成本有3.5亿元,为啥白白扔掉而不是回收?
- 干细胞疗法,呵护女性“生命的花园”
- 外国女子意外流产后用小刀割断脐带,却被控\杀害婴儿\,被判50年
- 14岁女孩留下遗书,考上北大后割腕:没有谁愿意被脐带拴一辈子







