
文章图片
文章图片
文章图片
文章图片
文章图片
文章图片
文章图片
太空微重力环境会造成航天员严重的骨质流失和骨质疏松 。 为了探究其中的生物学机制 。 11月12日 , “天舟五号”货运飞船在文昌航天发射场顺利升空 , 搭载的浙江大学生命科学学院余路阳教授、王金福教授团队的干细胞实验单元也将抵达中国空间站 , 与此前安装在问天舱内的生物技术实验设备“会师” 。 在“神舟十四号”航天员乘组的操作下 , 中国空间站迎来了首个干细胞研究项目 。 在中国空间站中 , 空间实验装置将诱导人骨髓间充质干细胞向骨细胞分化 , 并进行实时显微成像 。 在轨实验完成后 , 实验装置中的细胞样品还将随航天员重返地面 , 接受进一步的生物学分析 。
华东师大科学家开发出高精度新型胞嘧啶碱基编辑系统
近日 , 华东师大李大力、刘明耀团队合作对腺嘌呤脱氨酶TadA-8e重新设计改造 , 创新性地构建了一系列“精准且安全”的新型胞嘧啶碱基编辑器 , 编辑窗口更加精准 , 脱靶率极低 。 该研究成果在Nature Biotechnology杂志上发表 。
目前已知的人类遗传疾病约60%是由碱基突变引起的 , 因此开发高效精准且安全的单碱基编辑器对基础研究和人类遗传疾病的治疗具有极为重要的意义 。
哈佛大学David R. Liu团队开发出可实现C到T碱基转换的胞嘧啶碱基编辑器(Cytosine base editor CBE)以及A到G碱基转换的腺嘌呤碱基编辑器(Adenine base editor ABE) , 这两类碱基编辑器能在CBE的基础上 , 通过对APOBEC1的改造等策略开发了主要实现C到G碱基颠换的CGBEs 。
然而现有的CBEs/CGBEs均依赖于天然的胞嘧啶脱氨酶AID/APOBEC家族成员 , 由于胞嘧啶脱氨后会激活碱基切除修复通路 , 不可避免的会产生较高的indels副产物 。 更为重要的是现有的CBE会产生显著的不依赖于Cas9的DNA和RNA随机脱靶 , 而且较宽的编辑窗口引起难以避免的旁观者效应 , 在安全性等方面存在隐患 。
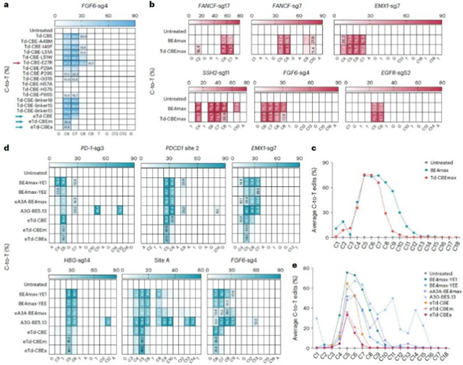
华东师范大学生命科学学院李大力、刘明耀团队以及北京大学生命科学学院伊成器课题组合作通过对腺嘌呤脱氨酶TadA-8e重新设计改造 , 创新性地构建了一系列不依赖天然胞嘧啶脱氨酶家族的“精准且安全”的新型胞嘧啶碱基编辑器—TadA-derived CGBE/CBEs (Td-CGBE/Td-CBEs) , 其中Td-CGBE能高效精确地诱导C到G的转换 , 而进一步的分子进化获得了与BE4max活性相当但编辑窗口更窄的Td-CBEs系列 。
更为重要的是 , 消除了固有的腺嘌呤脱氨酶活性的新型CGBEs/CBEs , 展现出非常低的indels事件 。 通过项目组前期开发最高灵敏度CBE脱靶检测技术Detect-seq , 证明Td-CBEs相较于BE4max展现接近背景水平的更低的脱靶效应 。
首先 , 该研究证明了ABE尤其是高活性ABE8e可介导高效的胞嘧啶编辑 , 猜测TadA-8e脱氨酶对腺嘌呤和胞嘧啶有一个共同的催化口袋 , 活性位点及其周围的关键氨基酸改变可能会影响催化底物的选择 。
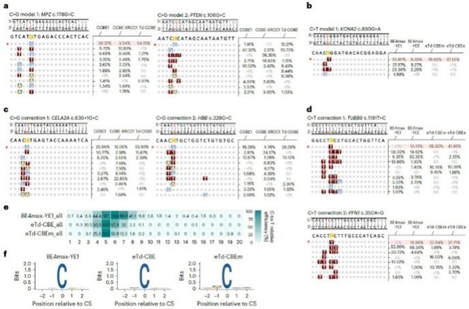
令人惊喜的是 , 其相对于传统的CGBE编辑器 , 该突变体具有更低的indels , 且编辑窗口显著缩窄到1-2个碱基 (C5-C6) 。 由此开发了首款不依赖于天然AID/APOBEC家族酶的CGBE , 命名为TadA-derived CGBE(Td-CGBE) 。 (图1)
图1:TadA-8e蛋白结构及Td-CGBE特性评价
Td-CGBE高精确度的特性为进一步开发精准的C到T的碱基编辑器奠定基础 , 项目组通过对TadA-8e结构中可能与底物相互作用的关键区段重新改造、linker序列以及UGI串联等多轮优化获得了一系列Td-CBEs , 发现其依然表现为完全消除腺嘌呤编辑的特性 , 其中TadA-8e引入关键突变E27R 获得的Td-CBEmax , 在13个靶点测试后发现 , 其保留高效的C到T编辑活性 , 产生与BE4max相似的编辑活性(57.7%-94.9%) , 但编辑窗口显著缩小到sgRNA的5-7位 , 而且产生显著降低的indels频率 。







