
文章图片
出品丨虎嗅科技组
作者丨苏北佛楼蜜
编辑丨陈伊凡
题图丨电影《困在时光里的父亲》
有一种疾病 , 被文学化的称为“脑海中的橡皮擦” , 医学上它被称为阿尔兹海默症 , 但它也拥有一个略显讽刺的称呼——“老年痴呆” 。
两年前 , 因为美国食品和药物管理局 (FDA)坚持批准渤健的阿尔兹海默症药物——aducanumab , 科学顾问小组以8票对1票反对批准 , 三名小组成员在FDA批准后辞职 。
这一消息仿若就发生在昨日 , 但仍无法阻止如今渤健在该领域突飞猛进的决心 。
当地时间1月7日 , FDA再次正式批准其研发药物 lecanemab , 这是有史以来第二种治疗阿尔茨海默病的药物 , 旨在解决该病的根源并减缓认知能力下降 。
渤健喜上眉梢 , 但兴奋情绪因部分患者服药后死亡而蒙上阴影 。
急迫的FDA
获批药物主要以“β淀粉样蛋白”为标记物 , 它是一种在阿尔兹海默症患大脑中积累的蛋白质 。 该领域的许多科学家认为 , 它是造成脑细胞死亡的原因 , 具体表现为夺走人们的记忆 , 最终彻底杀死脑细胞 。 但值得注意的是 , 在健康人的大脑中也发现了这种蛋白质的沉积物 。
本次批准的药物lecanemab , 将以Leqembi品牌销售 , 由日本制药公司 卫材和渤健合作开发 , 对于普通患者来说 , Leqembi每年的费用所带来的压力不小——26500美元 。
FDA 的批准决策依托于一项大型试验的结果 , 结果表明在18个月内 , 与安慰剂相比 , Leqembi治疗使患者的脑内衰退减缓了27% 。 这一发现是 Leqembi 类药物在后期临床试验中的首次成功 。 尽管如此 , 专家们仍然对该药物感到不安 , 尤其当考虑到其潜在的安全风险时 。
虽然FDA在周五的公告中明确表明已经参考该试验结果结果 , 但Leqembi的批准主要基于一项早期的研究 。
研究招募了800多名早期阿尔茨海默病患者 , 并测试了不同剂量的 Leqembi所产生的效果 。 研究发现 , 在18个月的治疗期间 , 与安慰剂相比 , 接受最高剂量治疗的患者认知能力下降速度较慢 。 但有一点需要说明 , 衡量结果根据的是卫材自己创建的量表 。
FDA认为 , Leqembi发挥了设计作用——分解一种叫做淀粉样蛋白的脑蛋白的聚集体 。 II 期研究发现 , 856名患者大脑中的斑块含量减少 , 但没有评估这是否会影响患者的认知能力 。
称为淀粉样斑块的蛋白质团块(金色 , 在该计算机插图中的蓝色神经元之间)是阿尔茨海默病的标志 。 图片来源:Juan Gaertner/Science Photo Library
早在2021年 , FDA 同样批准了另一种百健和卫材的药物Aduhelm, 它具有结合和消除淀粉样蛋白质簇的能力 , 这让它成为美国批准的第一种用于治疗阿尔茨海默氏症的疗法 。
目前 , 尚不清楚27%的影响会对阿尔茨海默氏症患者的生活产生什么影响 , 同时 , 这种影响是否会在18个月后持续存在也仍未可知 , 与此同时 , FDA表示 , Leqembi将仅用于轻度认知障碍患者 。
仅以美国为例 , 轻症患者主要占总患者数量的十分之一 , 属于“少数群体” ,
风险犹存
事分好坏 , 死亡是该药物背后隐匿的怪兽 。
试验发现 , 虽然Leqembi似乎可以减缓阿尔茨海默氏症患者的认知能力下降速度 , 但期间仍发生了与该药物相关的第三例死亡病例 , 这让业内人士和患者开始担忧它的安全性 。
知名学术期刊Science获得的医疗记录显示 , 一名79岁的佛罗里达州妇女在服用该药物后 , 先后经历严重脑肿胀、出血以及癫痫发作 , 2022年9月中旬 , 该患者正式死亡 。
多位神经科学家认为 , 她的死亡很可能是由抗体Leqembi导致 。
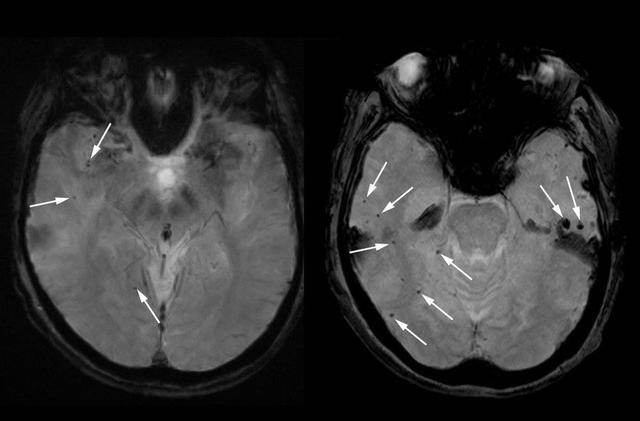
佛罗里达州一名妇女在临床试验中使用 lecanemab之前 , 她的大脑(左)的 MRI 扫描有一些微出血——微小的出血(黑点 , 用箭头标记) 。 之后(右) , 微出血更多且更明显(用箭头标记) , 图片来源:Science
“脑肿胀和微出血……可能是研究药物的严重副作用 。 ”莱顿大学的神经科学家和神经学家 Ellis van Etten对外表示 , 病强调试验研究人员应该对副作用展开严谨评估 。
吊诡的是 , 上个月 , 该临床试验的赞助商日本生物技术卫材在一场阿尔茨海默氏症会议上没有透露死亡人数 , 会上仅是详细介绍 Leqembi的III期试验数据 。
推荐阅读
- 诺贝尔奖颁奖(量子研究):多名科学家瓜分奖金
- 将人类的大脑移植到其他动物的大脑会发生什么?
- 全球变暖很可能会超过1.5度的上限 我们需要做得更多
- “生物圈2号”揭露真实人性?4男4女在封闭空间生活2年,会怎样?
- 太阳的背后隐藏着另一个“地球”?若是存在,将是一个好消息
- 科学家发现一种新的古代海龟物种 同时也是在欧洲发现的最大海龟
- 国际Fun|焰火秀闪耀世界,人类为何偏爱烟花?
- 永远消失的核酸亭……
- 干细胞治疗糖尿病又有新突破!瑞普晨创在Nature Metabolism发布胰岛移植新策略







