
文章图片

文章图片
文章图片
上周 , 华中科技大学
化学与化工学院钟芳锐、吴钰周教授团队
与西北大学陈希教授合作的论文
Enantioselective [2+2
-cycloadditions with triplet photoenzymes
【有机合成重大突破!华中科技大学,再发Nature!】在《自然》Nature刊发
吴钰周、钟芳锐和陈希为本文的共同通讯作者 , 化学与化工学院博士生孙宁宁和黄建建为本文的共同第一作者 , 华中科技大学为该论文的第一作者单位 。
酶是自然界漫长演化形成的高效生物催化剂 , 但往往仅适用于专一的底物和天然的生命化学反应 , 难以满足社会生产对多样性功能化学品的合成需求 。 近年来 , 随着合成生物学理论与技术的发展 , 通过在蛋白中人为设计和引入非天然活性中心构建人工酶 , 能够极大地拓展酶的催化反应性 , 从而实现更多样化非天然有机化学品的生物催化合成 。
虽然自然进化形成的生物酶数量和种类繁多 , 功能多样 , 但绝大多数都是基于热化学驱动活化机制 。 能受光驱动的天然光酶十分稀缺 , 目前已经发现的光酶仅有光合作用相关的原叶绿素酸酯还原酶、修复DNA损伤的光裂合酶、脂肪酸脱羧酶等少数几种 。
将合成化学发展的光催化剂和光催化机制融合到蛋白中构建新型人工光酶 , 能突破天然酶热催化机制的局限 , 从根本上拓展生物催化的反应类型 , 为重要功能化学品的绿色生物制造提供新的理论和技术 。
另一方面 , 手性与生命现象密切相关 , 也显著影响物质的性能 。 手性分子的精准合成能为医药、农药、信息和材料领域的发展提供核心技术支持 。 不对称催化是制备手性分子十分高效的途径 , 这一领域的研究在过去半个世纪里已经取得了巨大的进展 。 然而 , 在激发态进行的光化学反应的手性控制仍然是一个巨大的挑战 。
“三重态光酶”的艺术示意图
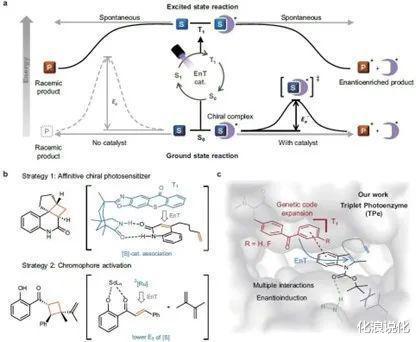
图1. TPe的定向演化针对上述问题 , 钟芳锐、吴钰周团队提出了“三重态光酶”的概念 , 通过合成生物学前沿技术开发了一类全新的人工酶 , 为激发态光反应的手性催化合成提供了一种原创性方案 。
团队基于有机合成、基因工程、蛋白质工程、酶理论计算和结构生物学等交叉学科背景 , 将合成化学发展的二苯甲酮类优异光敏剂通过基因密码子拓展技术定点插入到选定蛋白的手性空腔中 , 构建了含非天然催化活性中心的人工光酶TPe 。
由于二苯甲酮独特优异的三重态光物理性质 , 该光酶具有能量转移催化的非天然功能和作用机制 , 能催化底物从分子基态跃迁到激发态发生光反应 。 从化学改造构建的第一代三重态光酶TPe1.0 , 团队通过四轮突变迭代优化酶的氨基酸残基和反应空腔结构 , 建立了突变体文库 , 完成了光酶的定向进化 , 最终获得了优异的突变体TPe4.0 。
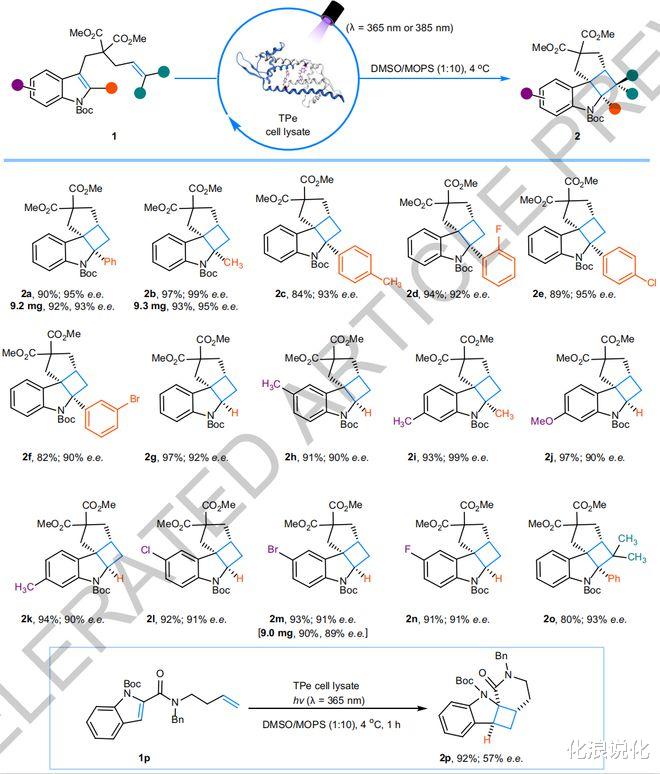
该光酶能高效催化吲哚衍生物的分子内[2+2
光环加成反应 , 所获得的环丁烷并吲哚啉类产物具有良好的底物普适性和手性选择性(可以获得大于99%的单一手性异构体) 。 陈希团队通过X-射线解析光酶与底物配合物的单晶结构 , 阐明了反应优异的手性选择性来源于光敏剂和周边关键氨基酸残基与底物之间形成的氢键等多重弱键协同作用 。
三重态光酶(TPe)催化能量转移[2+2
光环加成反应示意图
图2. 设计用于对映选择性[2+2
环加成的三重态光酶(TPe)这项研究表明 , 通过将三重态能量转移的光催化机制与蛋白质的精细超分子腔相结合 , 人工三重态光酶集成了化学光催化剂的高效反应性和生物催化剂的精准选择性两者的优势 , 为有机分子激发态反应的手性选择性调控提供了有效的手段 , 也从根本上拓展了酶催化的反应性 。
随着计算辅助的人工酶理性设计能力的不断提升和基因密码子拓展技术的进一步发展 , 更多结构和性质独特的化学光敏剂将被引入蛋白创造新的非天然光酶 , 从而丰富光驱动生物催化的功能和应用范围 。
推荐阅读
- 科学界提议禁止研究量子意识?诺奖得主:量子叠加可能是思维状态
- 距离这么近,太阳都没“吞掉”水星,天体为啥要绕圈运动?
- 哺乳动物有4000多种,为何人类不仅没有繁殖期,还隐藏排卵期?
- 柏拉图的犀利观点:批判傲慢无知的人类,批判引以为傲的文明成果
- 李华兵等人合作揭示tRNA-m1A修饰调控CD4+T细胞功能的新机制
- “银心”长什么样?经过科学家多年数字化模拟,终于揭露其真相
- 世界上只有两种人:爱吃和不爱吃香菜的人!差别真是基因决定的吗
- 中国发布|中国牵头制定并发布全球首个干细胞国际标准 ISO 24603
- 关于“地球是圆的”的探讨







