文章图片
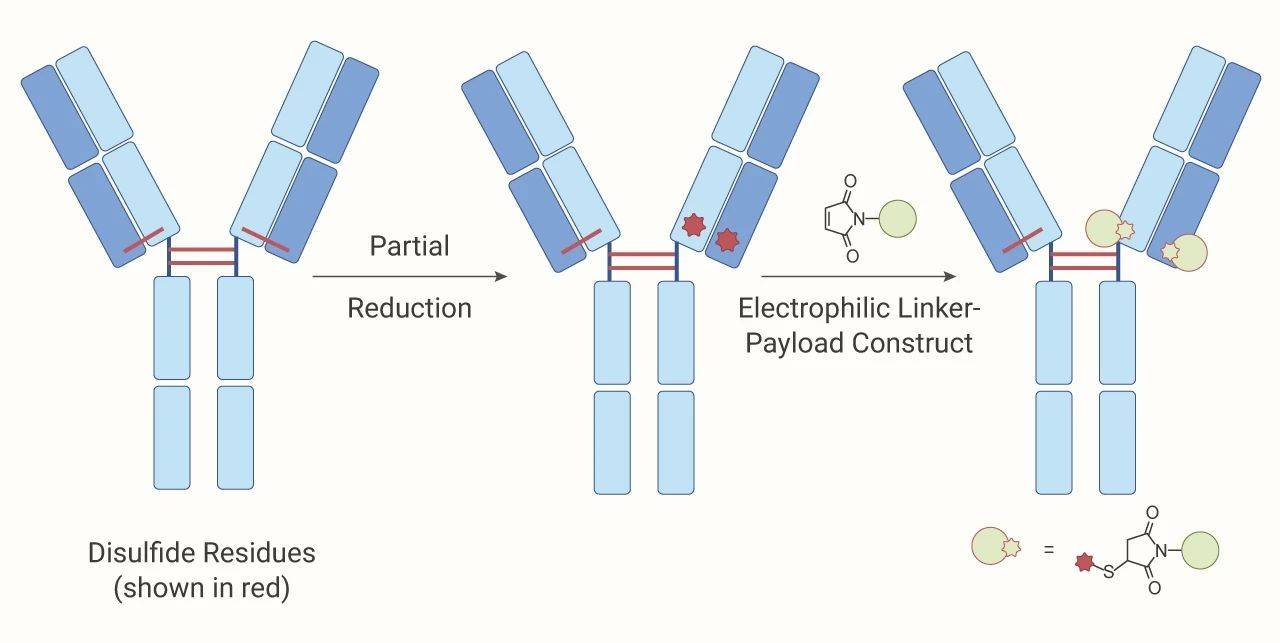
图 3. 硫醇基团偶联过程
位点特异性偶联 (硫醇基团的特异性偶联):最著名的技术要数 Genentech 的 THIOMABTM 技术了 。 THIOMABs 利用基因工程技术在抗体特定位置插入带有半胱氨酸残基 (游离硫醇) 。 半胱氨酸残基与 payload 偶联 , 这种定点偶联方式 , 得到的 ADC 的 DAR 为 2 。 在体内实验显示出优越的安全性 。
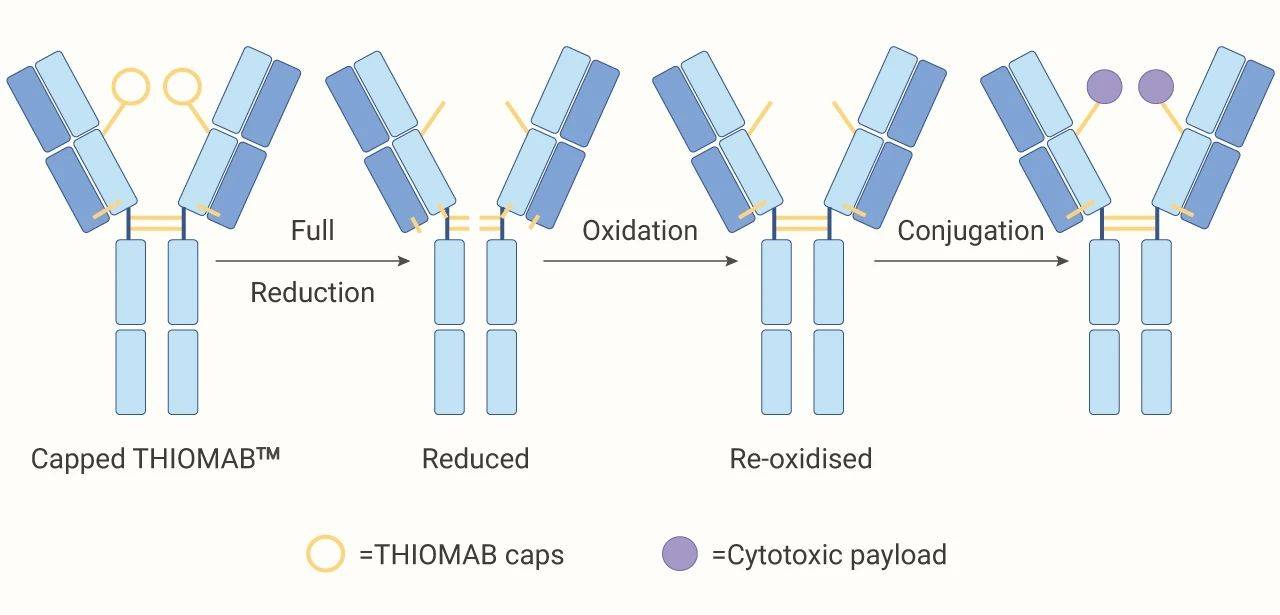
文章图片
图 4. 位点特异性偶联过程
点击化学偶联:这种方法常常使用含叠氮化物的 linker , 将叠氮化物基团连接到 payload 结构的末端 。 叠氮化物可以与加入抗体的 DBCO 基团反应 。 其优点是反应非常高效和高产 , 条件温和 。

文章图片
图 5. 点击化学偶联过程
其它偶联形式:除了上述以外 , 还有其它基于醇 (例如可以形成碳酸盐、醚和酯化合物) 和醛的偶联技术 (通过甲酰甘氨酸生成酶 (FGE) 偶联) , 通过工程氨基酰基——tRNA (aaRS)、氧化唾液酶和转氨试剂的偶联技术实现 。
■ 那么如何检测 ADC 的“好与坏”呢?
药物抗体比 (DAR):目前已经发展了很多测定 DAR 的方案 , 包括全抗体质谱法、分光光度计测试法和各种色谱方法 (包括但不限于 HPLC、UV/VIS 紫外/可见光光谱分析) 。
ADC 中未结合毒素的测定:反相 (RP)-HPLC 可用于根据外部标准曲线定量未缀合的有效载荷连接器的含量 。
疏水性预测:在新 ADC 的发现和开发阶段 , 为了降低 ADC 的疏水性 , 尽可能降低有效毒素分子和连接子的分子量是至关重要的 。 在环结构和链中尽可能多的杂原子 , 以及尽可能多的亲水官能团作为取代基 (如-NH2、-OH/-COOH) 有助于优化亲水性 。
ADC 的体外效价随着 DAR 的增加而增加 , 但是 ADC 的血浆清除率也随着 DAR 的增加而增加 , 从而减少了药物暴露和体内生物效果 。 亲水性改善后的 ADC 明显具有优越的体内活性 。 亲水性改善后的ADC , 血浆清除率降低 , 体内活性明显改善 。
■ ADC 发展中的挑战和机遇
连接的不稳定性:这种不稳定性可导致 payload 过早释放到血液中 , 并导致 ADC 的非特异性摄取和脱靶毒性 。 第一代的 ADC 具有酸可降解键 (如腙) , 其在偏中性 pH 的血浆中保持稳定 , 内化后在较低 pH 值的溶酶体中释放 。 但这种 linker (尤其是基于多肽的 linker) 会对血清蛋白酶敏感以及自发解偶联现象导致其在血浆中不稳定 。 和可降解 linker (SPP-DM1 和 VcMMAE) 相比 , 不可降解的 linker (mcc-DM1 和 mcMMAF) 具有更低的肝脏和血液毒性 。 因为其 payload 释放少 , 细胞毒性减小 。 但是不可降解 linker 不适用于所有靶点 , 毕竟需要单抗完全分解代谢才能释放 payload , 另一方面 , 可降解 linker 导致 payload 的过早释放也可能通过“旁观者效应”发挥更好的疗效 (旁观者效应:活跃的 payload 也可能杀死周围的肿瘤细胞) 。
推荐阅读
- 疫苗|奥密克戎对抗体中和作用存在大量逃逸现象
- 法国|奥密克戎对抗体存大量逃逸现象
- 抗体|六大科学突破闪亮二〇二一
- 数学|中考数学阴影部分面积计算方法总结
- 定义|时间走向二维,基于文本的视频时间定位新方法兼顾速度与精度
- 电阻|电缆故障测试仪判定电缆故障性质的方法
- 空气|购买GF80/58-1空气弹簧的好方法是什么?
- Microsoft|微软专利分享HoloLens通过光线投射与远距离对象进行交互的方法
- 密封|双组份聚硫密封胶、施工方法
- 方法论|[译]Objective-C依然占C位,Swift和SwiftUI在iOS 15中的使用情况







